

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
近期,青岛大学王昆教授发表名为“The piRNA CHAPIR regulates cardiac hypertrophy by controlling METTL3-dependent N6-methyladenosine methylation of Parp10 mRNA”的研究性论文。该论文应用Arraystar Mouse piRNA芯片筛选鉴定出与心肌肥大相关的piRNA分子CHAPIR,并通过进一步机制研究检测(如MeRIP seq等)发现该分子通过结合METTL3影响Parp10的甲基化来发挥调控功能。该研究成果于2020年10月发表在国际著名学术期刊Nature Cell Biology (IF: 17.728)上。(Arraystar piRNA芯片及MeRIP测序均由康成生物丨数谱生物提供技术服务)
 |
研究背景
慢性心肌肥大及相关的心肌重塑是心脏功能障碍的主要影响因素,最终会导致严重的心衰和死亡。近期研究表明,mRNA的表观遗传修饰对心血管疾病的发展有重要影响,其中m6A是哺乳动物最主要的mRNA转录后修饰,可逆的m6A修饰对mRNA的剪切、稳定性、定位和翻译起着重要作用。已有研究证明m6A影响心脏生理和病理过程,然而,尚不清楚在肥厚性心肌细胞中m6A修饰失调的影响。
非编码RNA(ncRNA)在生理和病理性心肌肥大中发挥独特的调控功能,它们通过对基因的转录或转录后沉默来调控心肌肥大的分子互作网络。PiRNA是一类长26-32nt的小非编码RNA,在生殖细胞中,piRNA结合PIWI蛋白介导转座子和蛋白编码基因的调控。尽管在心肌组织高丰度表达,但piRNA在心脏生理功能和疾病发生中作用仍然未知。在多能干细胞分化成心肌细胞过程中,piRNA具有动态和特异性表达模式;在心梗和心肌肥大等压力条件下,piRNA表达也发生了很大变化。
本次研究系统地探讨了piRNA在病理性心肌肥大中的未知功能,揭示了piRNA通过结合m6A修饰酶METTL3影响RNA m6A修饰失调,从而介导肥大基因调控的潜在机制。
技术路线

研究思路
piRNA高通量筛选及验证
为了筛选到心肌肥大过程中差异表达的piRNA分子,作者应用Arraystar Mouse PiRNA芯片筛选了成年小鼠横切主动脉缩窄(TAC)手术后4周获得的左心室组织(心肌肥大模型组)与假手术对照组织中piRNA整体表达情况,并从中选择差异倍数前20的高丰度piRNA(原始信号>100)进行验证(图1A)。
在4 vs 4的样本中qPCR验证结果显示,3个piRNA上调超过3倍,2个piRNA下调超过3倍。随后经过表达实验验证这3个上调piRNA对于心肌肥大标志基因Myh7表达的影响以及q-PCR鉴定不同piRNA的组织特异性(图1B、C),作者锁定了一个在心脏中特异的且促进Myh7表达的piRNA分子DQ726659,并将其命名为CHAPIR(心肌肥大相关piRNA)。
功能研究
为了证明CHAPIR能够促进心肌肥大的发生发展,首先作者在小鼠原代心肌细胞中敲低CHAPIR,发现原本由血管紧张素II刺激引发的Myh7上调的表型得到减弱,同时细胞表面积等相关指标也有所降低(图2A、B)。进一步的,在小鼠模型上的研究表明,敲除CHARIP能够抑制由TAC手术引发的心肌肥厚现象(图2C),并且相关的标志基因等反映心肌肥厚程度的指标也有所降低。因此,CHAPIR对于心肌肥大的发生发展具有重要作用。
机制研究
进一步的,作者研究了CHAPIR促进心肌肥大的作用机制。首先,通过RNA pull down与质谱实验联用以及低通量验证的方式,作者意外发现甲基化修饰转移酶METTL3能够与CHAPIR具有相互作用(图3A)。Dot blot实验表明,敲除CHAPIR能够显著提高细胞内整体的m6A修饰水平(图3B)。为了找到CHAPIR影响下游基因甲基化的具体机制,作者利用MeRIP-seq(由康成生物丨数谱生物提供技术服务),在CHAPIR过表达的小鼠心脏组织中找到六千多个具有差异m6A修饰的基因。接下来,利用m6A差异修饰数据与对应mRNA表达量差异数据进行联合分析,作者找到了Parp10(图3C、D)。利用MeRIP-PCR实验发现,在过表达CHAPIR后,Parp10上的m6A修饰减少(图4A),同时Parp10的mRNA表达量上升(图4B),而敲低METTL3具有类似的现象(图4C)。进一步的,作者通过western blot等实验发现,Parp10能够通过影响下游GSK3β的单ADP核糖基化(mono-ADP-ribosylation)以及NFATC4的细胞核定位,从而影响心肌肥大的发生发展。
结果展示
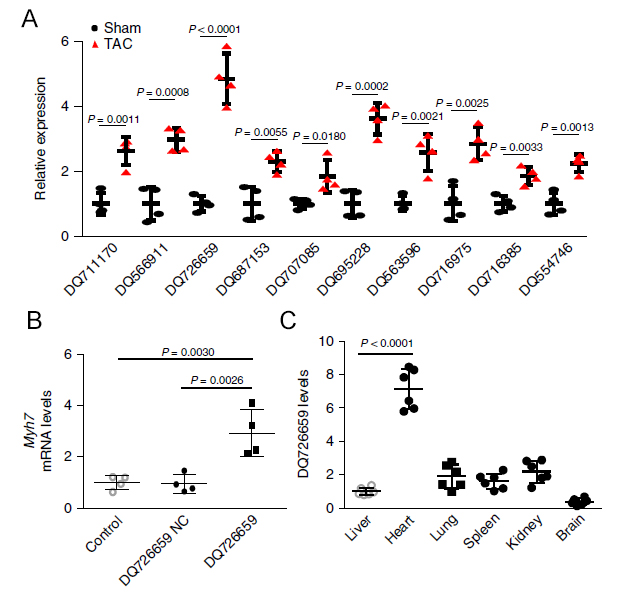
图1. Arraystar Mouse PiRNA芯片筛选找到CHAPIR
A:Q-PCR验证Arraystar Mouse PiRNA芯片筛选得到的在TAC诱导心肌肥大小鼠模型中表达上调的前十个piRNA。B:Q-PCR检测心肌细胞中过表达CHAPIR(DQ726659)后心肌肥大标志基因Myh7的表达情况。
C:Q-PCR验证CHAPIR在不同组织中的表达情况。
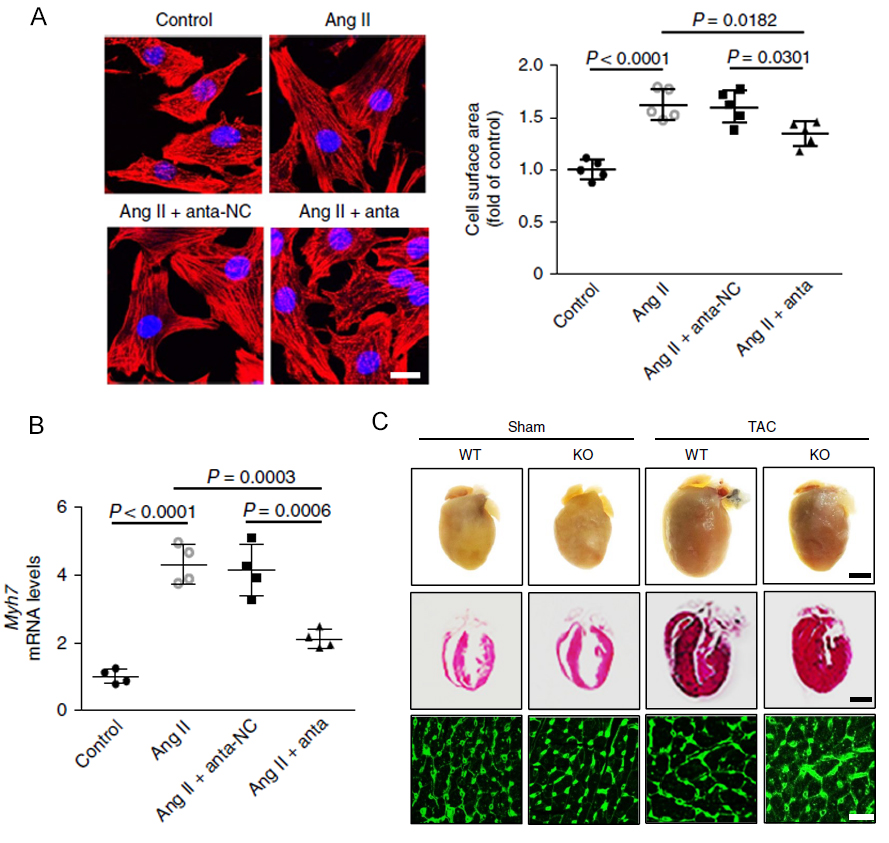
图2. CHAPIR敲低抑制心肌肥大
A:免疫荧光检测小鼠原代心肌细胞中敲低CHAPIR对细胞表面积的影响。B:Q-PCR检测小鼠原代心肌细胞中敲低CHAPIR对细胞内心肌肥大标志基因myh7的表达情况的影响。C:在TAC处理诱导心肌肥大小鼠模型中,敲低CHAPIR回复心肌肥大的表型。
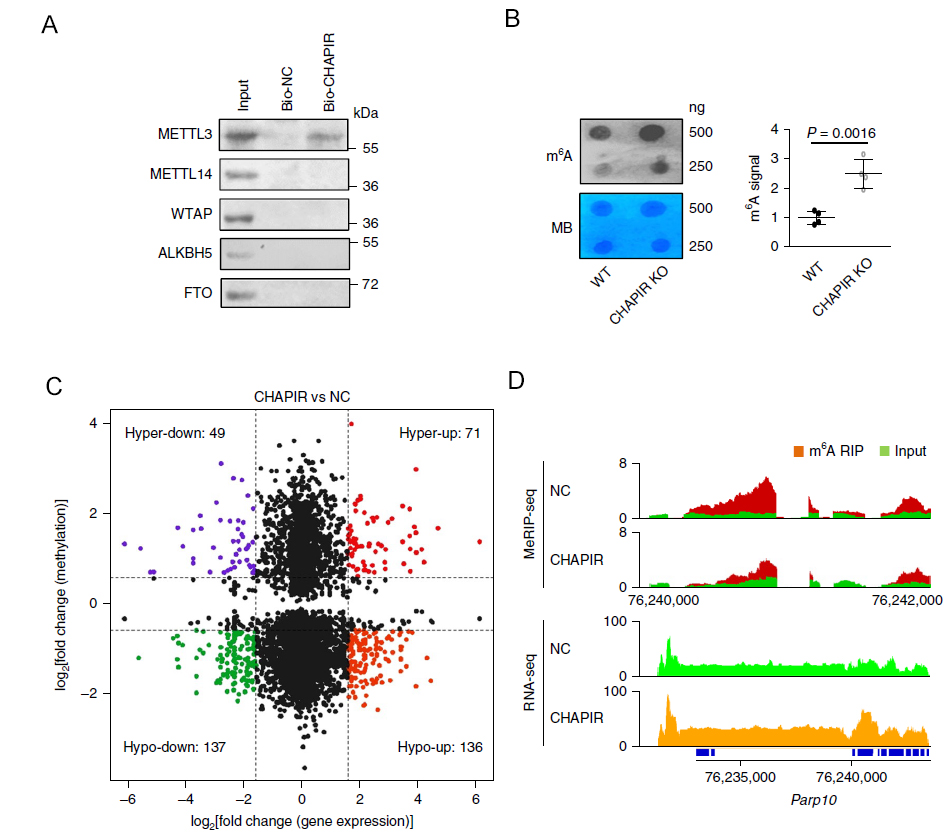
图3. CHAPIR结合METTL3影响Parp10的m6A修饰
A:RNA pull down验证CHAPIR能与METTL3结合。B:Dot blot实验表明CHAPIR敲除能够增强细胞内RNA的m6A修饰水平。C:取过表达CHAPIR的小鼠心脏组织与正常组织一起进行MeRIP-seq及RNA-seq实验,将差异基因表达数据与差异m6A修饰变化数据进行联合分析,最终找到Parp10。D:Parp10 mRNA上的m6A修饰变化情况与基因表达变化情况的可视化结果。
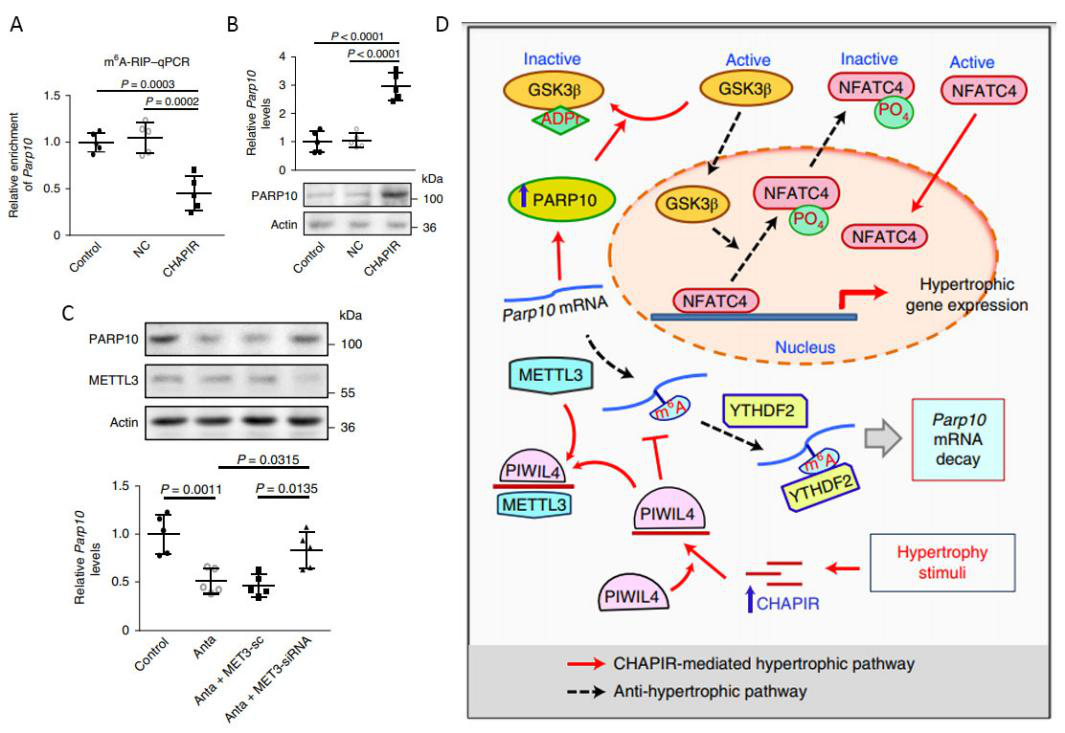
图4. M6A修饰影响Parp10的稳定性
A:MeRIP-PCR验证过表达CHAPIR能够降低Parp10的m6A修饰水平。B:Western blot检测过表达CHAPIR后Parp10的mRNA变化情况。C:Q-PCR及western blot检测敲低METTL3后Parp10的mRNA水平及蛋白水平变化情况。D:CHAPIR发挥促进心肌肥大的作用机制图。在外界信号刺激下,piRNA分子CHAPIR的表达量升高,随后与PIWI蛋白及METTL3结合,导致Parp10的mRNA上m6A修饰减少,使Parp10的mRNA稳定性增加,进一步让Parp10的蛋白表达量上升。表达量升高的Parp10能够通过影响GSK3β的单ADP核糖基化以及NFATC4的细胞内定位从而促进心肌肥大相关基因的表达。
研究意义:
作者利用Arraystar Mouse piRNA芯片在心肌肥大小鼠模型的心脏组织中找到了促进心肌肥大发生发展的piRNA分子CHAPIR。细胞层面上的功能研究表明CHAPIR能够促进心肌细胞表达心肌肥大标志基因myh7。小鼠模型上的功能研究则直接证明了CHAPIR能够影响心肌肥大的表型。机制上,作者发现CHAPIR能够通过结合甲基转移酶METTL3,影响其下游基因Parp10的m6A修饰。而m6A修饰则能够调节Parp10的mRNA稳定性,进一步影响该基因的蛋白表达,从而最终影响心肌肥大相关基因的表达情况以及相应的表型。总体而言,这项工作思路清晰,数据详实,为心肌肥大的治疗提供了新的思路与方法。
相关技术服务:

