

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
相关服务
CoIP-MS eCLIP-seq ChIP-seq mRNA&lncRNA表观转录组芯片 RNA测序 Label free非标定量相关产品
相关资源
O‑GlcNAc(O‑linked β‑N‑acetylglucosamine,O-乙酰葡萄糖胺)是一种蛋白质的糖基化修饰,发生在丝氨酸/苏氨酸残基上,带有O-GlcNAc修饰的蛋白在细胞核、细胞质与线粒体中都有广泛的分布,可通过感知营养和应激信号调控细胞功能[1]。O‑GlcNAc是可逆的蛋白翻译后修饰,添加酶为OGT(糖基转移酶,O-GlcNAc transferase),去除酶为OGA(糖基水解酶,O-GlcNAcase),两者共同维持糖基化修饰的动态平衡[2]。
O‑GlcNAc与泛素化、磷酸化等其他蛋白质修饰存在广泛互作与竞争,能够通过影响转录因子活性[3]、染色质状态、RNA m6A修饰[4]与信号传导等途径[1],从而参与代谢稳态[5]、细胞周期、应激反应与记忆/神经功能等关键过程[6]。异常的O‑GlcNAc修饰与肿瘤[7]、代谢性疾病[8]及神经退行性疾病密切相关,是许多疾病潜在的治疗干预靶点[9, 10]。
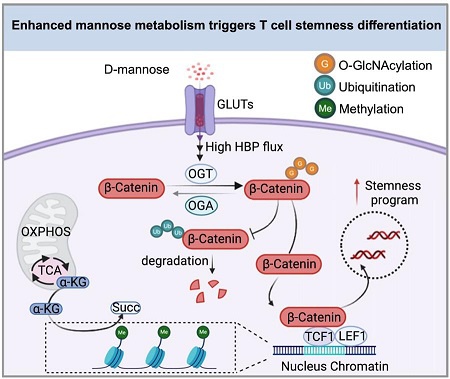
图1.O-GlcNAc修饰抑制转录因子泛素化、增强蛋白活性并调控下游基因表达
Aksomics全新推出O‑GlcNAc蛋白质组学检测平台,基于特异性富集与高分辨质谱的创新型分析方法,可同时检测蛋白质的O‑GlcNAc修饰水平和修饰位点。该方法利用琥珀酰化麦胚凝集素(sWGA)特异性富集捕获带有O‑GlcNAc修饰的肽段,并结合高分辨率质谱对修饰水平进行全面定量、对修饰位点进行精准鉴定。相比传统的糖肽检测方法,O‑GlcNAc平台不仅能够克服O‑糖肽短链、极性小、难以富集的技术瓶颈,还能在高通量条件下实现对修饰水平、位点分布的全面解析,为研究O‑GlcNAc在肿瘤发生、代谢失衡、神经退行性疾病及心血管病变中的作用机制提供了强有力的工具。
1.特异性与灵敏度兼备:通过sWGA对O-GlcNAc修饰蛋白的亲和富集与高分辨率质谱的精确检测,特异性好、灵敏度高,实现对O-GlcNAc修饰氨基酸残基位点的全面鉴定。
2.专业的数据分析:标准的搜库流程,专业的统计和生信分析,出版级的图表展示,完整全面的分析报告。
3.与Aksomics提供的其它服务平台联合分析:包括label-free非标定量蛋白质组、CoIP-MS蛋白互作检测实验、Arraystar m6A mRNA&lncRNA表观转录组芯片、eCLIP-Seq蛋白-RNA互作检测实验、ChIP-seq、mRNA-Seq等。
O‑GlcNAc蛋白质组学检测首先通过蛋白酶解获得肽段,再使用琥珀酰化麦胚凝集素sWGA选择性富集带有O‑GlcNAc修饰的肽段。经LC‑MS/MS高通量鉴定与定量,可精确定位Ser/Thr残基上的O‑GlcNAc修饰位点,并定量分析修饰水平。
1.蛋白O-GlcNAc修饰水平定量和修饰位点鉴定
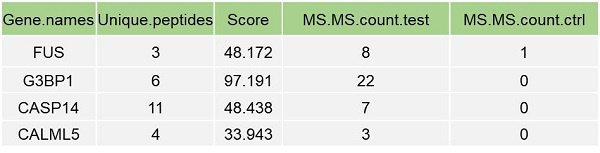
2.蛋白O-GlcNAc修饰水平差异分析
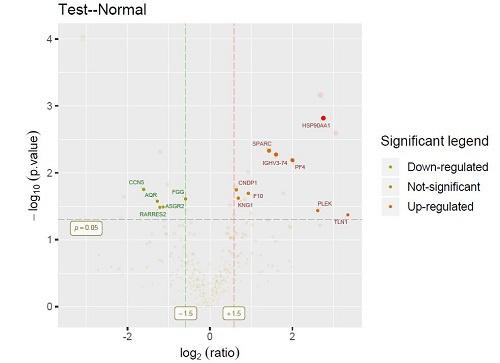
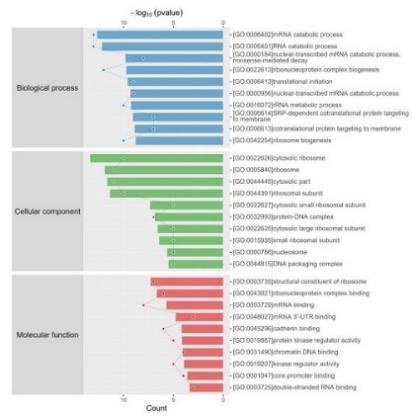
3.功能富集分析和蛋白互作网络分析
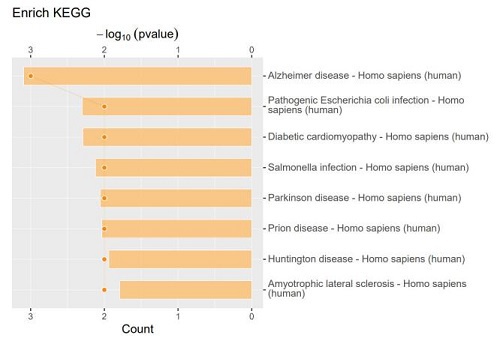
m6A阅读蛋白YTHDF2在HBV相关肝癌中具有O-GlcNAc修饰水平的显著提高,O-GlcNAc使YTHDF2稳定性和致癌活性显著增强。该修饰由OGT(糖基化转移酶)在Ser263位点介导添加,并可抑制YTHDF2的泛素化,从而延长蛋白半衰期并促进细胞增殖。
本研究利用质谱检测鉴定YTHDF2蛋白的O-GlcNAc修饰位点[4],并发现带有O-GlcNAc修饰的YTHDF2具有更高的稳定性,可以通过识别DNA复制起始复合物重要成员MCM2和MCM5的m6A修饰位点,进一步维持这些mRNA稳定性并推动细胞周期进程。抑制OGT或突变YTHDF2的糖基化修饰位点会削弱其功能,降低肿瘤细胞的生长和迁移能力。说明YTHDF2蛋白的O-GlcNAc修饰在HBV相关肝癌中可作为治疗的潜在靶点,具有相当重要的临床意义。
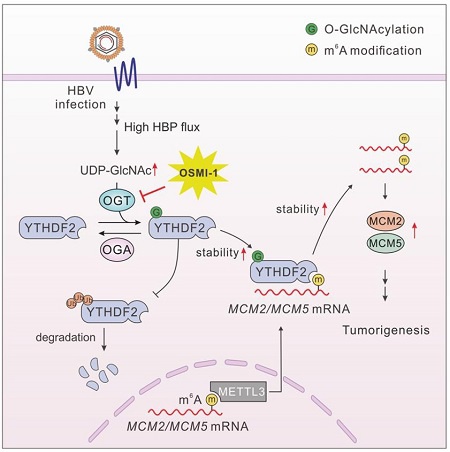
图2.O-GlcNAc修饰可促进YTHDF2稳定性,介导其与mRNA的结合并促进肿瘤增殖。
1. Zhang, H., et al., A ROS-mediated oxidation-O-GlcNAcylation cascade governs ferroptosis. Nat Cell Biol, 2025. 27(8): p. 1288-1300.
2. He, X.F., et al., O-GlcNAcylation in cancer development and immunotherapy. Cancer Lett, 2023. 566: p. 216258.
3. Qiu, Y., et al., Mannose metabolism reshapes T cell differentiation to enhance anti-tumor immunity. Cancer Cell, 2025. 43(1): p. 103-121.e8.
4. Yang, Y., et al., O-GlcNAcylation of YTHDF2 promotes HBV-related hepatocellular carcinoma progression in an N(6)-methyladenosine-dependent manner. Signal Transduct Target Ther, 2023. 8(1): p. 63.
5. Vigetti, D., et al., Natural antisense transcript for hyaluronan synthase 2 (HAS2-AS1) induces transcription of HAS2 via protein O-GlcNAcylation. J Biol Chem, 2014. 289(42): p. 28816-26.
6. Zhou, P., et al., High dietary fructose promotes hepatocellular carcinoma progression by enhancing O-GlcNAcylation via microbiota-derived acetate. Cell Metab, 2023. 35(11): p. 1961-1975.e6.
7. Phoomak, C., et al., O-GlcNAc-induced nuclear translocation of hnRNP-K is associated with progression and metastasis of cholangiocarcinoma. Molecular Oncology, 2019. 13(2): p. 338-357.
8. Gurel, Z. and N. Sheibani, O-Linked β-N-acetylglucosamine (O-GlcNAc) modification: a new pathway to decode pathogenesis of diabetic retinopathy. Clin Sci (Lond), 2018. 132(2): p. 185-198.
9. de Queiroz, R.M., É. Carvalho, and W.B. Dias, O-GlcNAcylation: The Sweet Side of the Cancer. Frontiers in Oncology, 2014. Volume 4 - 2014.
10. Ye, L., et al., O-GlcNAcylation: cellular physiology and therapeutic target for human diseases. MedComm (2020), 2023. 4(6): p. e456.

