

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
浙江大学基础医学院周天华教授长期从事细胞运动和细胞周期的分子调控及其在胃癌发生发展中的作用的研究。近期,该课题组应用Arraystar lncRNA芯片分析了胃癌组织和癌旁组织中lncRNAs的差异表达情况,发现lncRNA GMAN在胃癌组织中表达显著上调,并通过促进基因EFNA1的翻译来调控肿瘤的发生和发展。本研究为抑制胃癌的转移提供了新的治疗策略和潜在靶点。研究成果于2018年发表在国际著名学术期刊Gastroenterology (IF:20.773)上。(芯片实验由康成生物提供技术服务)
研究背景
胃癌(GC)是全世界范围内最常见的恶性肿瘤之一。并且,约40%的胃癌患者同时伴随有癌转移,其中95%的癌转移患者生存期不超过5年。由于对胃癌转移的生物学过程及其分子机制知之甚少,因此目前还缺乏针对胃癌转移的有效治疗手段。所以,阐明胃癌转移的分子机制对于寻找有效的胃癌治疗手段具有重要作用。
转录组学研究显示70%的基因组可以转录成RNA,其中大多数都是非编码RNA(lncRNA、circRNA、tRF和miRNA等)。长链非编码RNA(lncRNA)是一类长度在200nt以上的非编码RNA,多项研究结果表明lncRNA的异常表达和癌症的发生发展密不可分,但是lncRNA影响胃癌发生和转移分子机制仍是未知。
本文的研究目的筛选胃癌表达差异显著的lncRNA,并详细阐述lncRNA和胃癌转移之间的调控关系。
研究思路
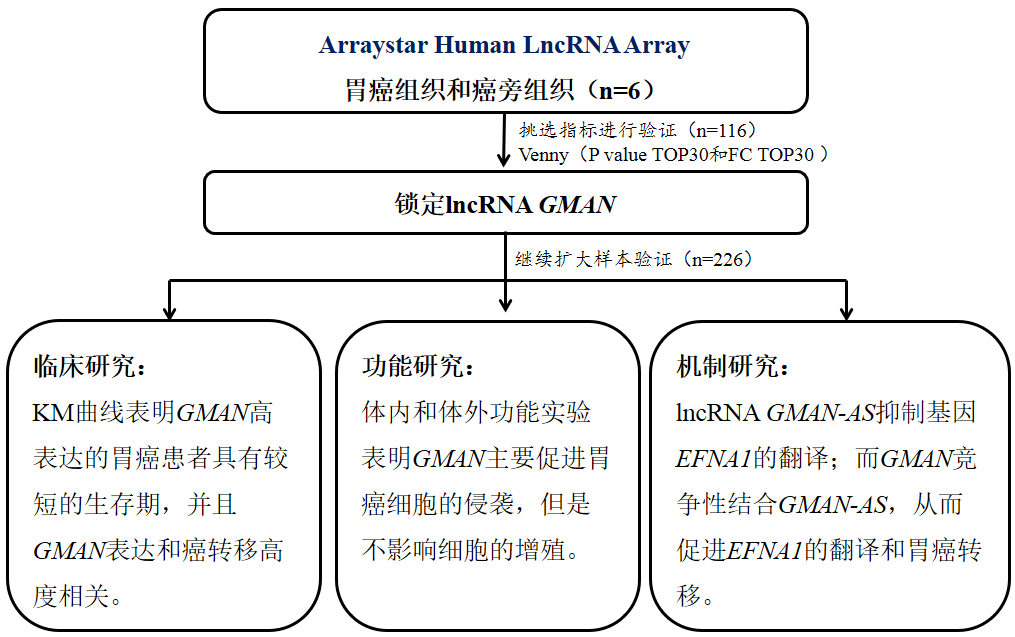
作者首先选取了6个胃癌患者的癌组织和癌旁组织,通过Arraystar lncRNA芯片筛选差异表达的lncRNA。总共筛选到151个上调和69个下调的lncRNAs。接着,根据上调的151个指标的韦恩分析结果挑选了4个lncRNAs继续扩大样本验证(n=112),验证结果显示lncRNA GMAN在胃癌组织中表达水平显著高于癌旁组织。然后,作者借助RACE、FISH、蛋白编码潜力预测和Northern Blot等实验对lncRNA GMAN的分子特征进行探究,发现GMAN是由基因EFNA1的intron 2和3区域转录出来的一条长度是855nt的lncRNA,并且它主要定位在细胞质中。
为了探究GMAN和胃癌以及癌转移的临床相关性,作者选取了两组样本(n=40和n=186)进行临床生存分析,K-M生存曲线显示GMAN高表达的患者生存期都比较短。而且与未发生癌转移患者的胃癌组织相比,癌转移患者的胃癌组织中lncRNA GMAN的表达水平显著上调。并且,TCGA数据库的大样本分析结果也证实了这个结果。
接下来,作者选取了胃癌细胞系BGC-823和HGC-27做GMAN的功能实验,过表达和干扰实验表明GMAN主要促进胃癌细胞的侵袭,但是不影响胃癌细胞的增殖。此外,体内实验也证实了GMAN可以促进癌细胞的肺转移。
考虑到GMAN是基因EFNA1的内含子区域转录出来,所以作者猜测GMAN是否调控EFNA1的表达。Northern blot和多聚核糖体结合实验表明GMAN不影响EFNA1的转录,而是促进EFNA1的翻译。前期已有文献报道EFNA1和肿瘤发生有关,作者在本研究中也证实EFNA1可以促进胃癌细胞的侵袭,但是不影响细胞增殖。因此,就锁定了GMAN下游调控的潜在靶点是基因EFNA1。
lncRNA GMAN又是如何调控EFNA1的翻译效率?作者继续做了深入的机制分析,发现基因EFNA1区域除了可以转录GMAN以外,还可以转录出来一条长度是2311nt的lncRNA GMAN-AS,并且GMAN-AS的序列和GMAN或EFNA1是部分互补。然后,作者通过一系列的截短实验证实lncRNA GMAN-AS和基因EFNA1的mRNA序列结合,从而抑制EFNA1的翻译和癌细胞的侵袭;而GMAN又可以竞争性结合GMAN-AS,来抑制GMAN-AS和EFNA1的结合,最终促进EFNA1的翻译和癌细胞的侵袭。
作者发现,临床胃癌组织中GMAN和GMAN-AS这两种lncRNA的比例与ephrin A1蛋白水平正相关。转移性胃癌病人组织中该比例较高,并且患者具有较短的生存时间。同时,作者借助CRISPR/Cas9技术靶向编辑GMAN,结果显示GMAN靶向处理组可以显著抑制癌细胞的肺转移,从而提高小鼠的生存时间。
综上所述,作者发现胃癌组织中GMAN和GMAN-AS这两种lncRNA的比例正向调控EFNA1的翻译效率和癌转移,同时也揭示了lncRNA调控基因转录后调控的新模式。此外,基于CRISPR/Cas9的研究结果为抑制胃癌的转移提供了潜在治疗靶点。
技术路线
结果展示
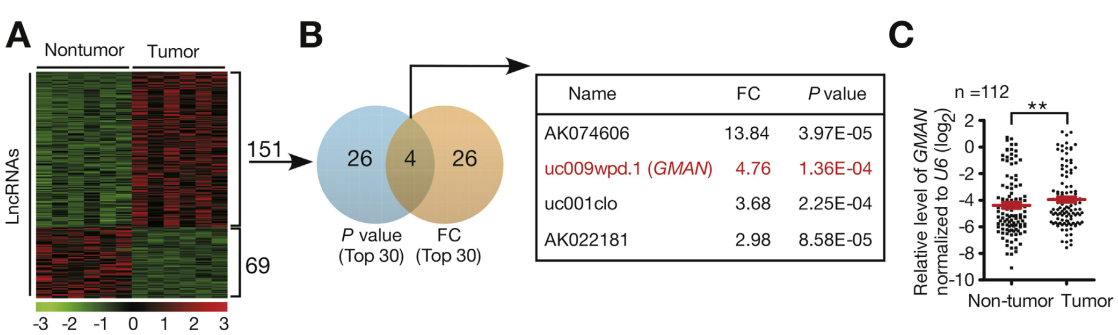
图1 芯片结果展示及扩大样本验证
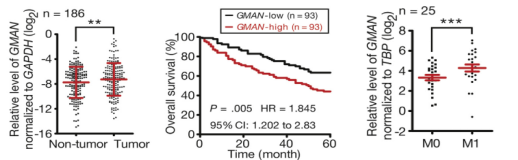
图2 lncRNA GMAN的临床相关性分析结果
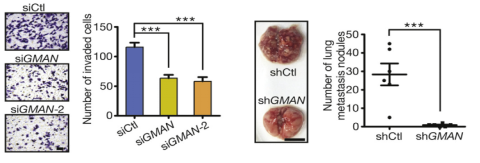
图3 lncRNA GMAN促进胃癌细胞的侵袭(体内实验和体外实验)
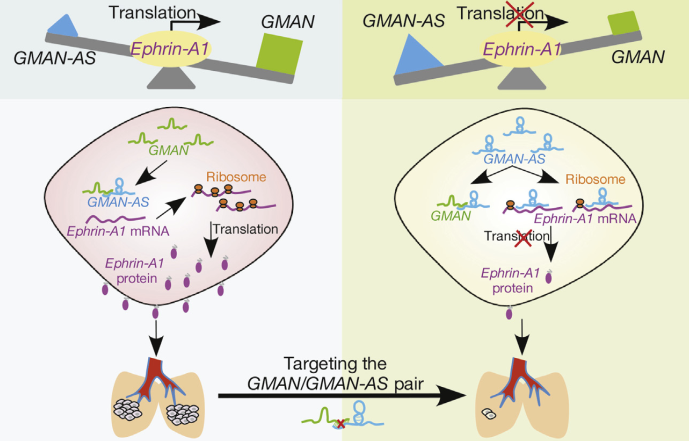
图4 lncRNA GMAN通过调控基因EFNA1的翻译效率促进胃癌转移
研究意义
该课题组借助Arraystar Human lncRNA 芯片筛选胃癌组织中异常表达的lncRNA。并经过进一步扩大样本验证和临床相关性分析发现lncRNA GMAN高表达的胃癌患者通常具有较短的生存期。体内和体外功能实验显示lncRNA GMAN主要是促进胃癌细胞的侵袭,而深入的机制实验证实GMAN是通过促进基因EFNA1的翻译进而调控胃癌的转移。该研究揭示了lncRNA调控基因表达的新模式,也为研究胃癌的癌转移和治疗提供了新的线索。
原文出处
Long Noncoding RNA GMAN, Up-regulated in Gastric Cancer Tissues, Is Associated With Metastasis in Patients and Promotes Translation of Ephrin A1 by Competitively Binding GMAN-AS.

