

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
近期,复旦大学中山医院院长樊嘉院士在肝癌领域发表了CircMEMO1 modulates the promoter methylation and expression of TCF21 to regulate hepatocellular carcinoma progression and sorafenib treatment sensitivity.的研究性论文。该论文应用美国Arraystar公司的Arraystar Human CircRNA芯片筛选鉴定出与肝细胞癌发生相关的circRNA分子circMEMO1,发现它通过miR-106b-5p/TET1/5hmC/TCF21轴和EMT过程发挥作用。CircMEMO1作为一个关键的表观遗传修饰因子,还可以调节肝癌细胞对索拉非尼治疗的敏感性。该研究成果发表在国际著名学术期刊Molecular Cancer(IF: 27.401)上。 (芯片实验由康成生物丨数谱生物提供技术服务)
研究背景
肝细胞癌(hepatocelluar carcinoma,HCC) 是最常见的恶性肿瘤之一,也是全球第三大癌症相关死亡原因。肝硬化向肝细胞癌 发展是一个多步骤过程,从发育异常结节 (dysplastic nodules, DNs) 到 HCC 病灶,然后是小 HCC,最终是明显的肝癌。即使经过手术治疗,HCC 患者的总体预后仍不令人满意。
CircRNA 是一种由共价闭合环化形成的新型内源性非编码 RNA,在肿瘤发生及发展中起着至关重要的作用 。很少有研究报道CircRNA在HCC与癌旁组织的发育异常结节(DN)中的表达情况。
研究思路
本文作者采用Arraystar Human CircRNA芯片及激光捕获显微切割(LCM)技术,分析了肝癌组织和癌旁DN组织中CircRNA的表达谱。然后,利用体外和体内的肝癌模型来确定关键的CircRNA在肝癌进展和治疗敏感性中的作用和机制。作者发现,CircMEMO1在肝癌组织中的表达明显下调,并且其表达水平与肝癌患者的总生存期(OS)无病生存期(DFS)密切相关。功能实验表明,circMEMO1可以抑制肿瘤细胞的迁移侵袭并影响肿瘤的生长和转移。机制分析表明,CircMEMO1可以作为miR-106b-5p海绵,调控TCF21的启动子甲基化和基因表达,从而调节肝癌的进展。miR-106b-5p靶向Tet家族,增加TCF21启动子的5hmC水平。更重要的是,CircMEMO1可以增加肝癌细胞对索拉非尼治疗的敏感性。
高通量筛选及临床数据研究
作者采用 Arraystar Human circRNA 芯片结合LCM 用于鉴定HCC 组织样本中与癌旁DN 样本相比差异表达的circRNA。确定了组间具有显著差异表达(差异倍数>2倍,p值<0.05)的circRNA,28个circRNA上调,18个circRNA下调(图1左上)。hsa_circ_0006790,称为circMEMO1,是下调最显著的一个circRNA(图1右上)。qRT-PCR 显示 circMEMO1 表达在 HCC 组织结节样本中显著下调(图1左下)。Kaplan-Meier 生存分析显示低表达 circMEMO1 的 HCC 的总生存期较差(图1右下)。
功能研究
为了研究circMEMO1在HCC进展中的生物学功能,作者构建过表达及敲低的circMEMO1慢病毒感染肝癌细胞系。通过细胞增殖、克隆和Transwell实验证明,敲除circMEMO1后Huh-7细胞的增殖、克隆和迁移能力显着增强;敲低circMEMO1时,HCCLM3细胞的增殖、克隆、侵袭和迁移能力受到显著抑制(图2左)。体外实验发现过表达circMEMO1可以显著抑制移植瘤的体积(图2右)。
机制研究
机制分析表明,CircMEMO1可以作为miR-106b-5p海绵,调控TCF21的启动子甲基化和基因表达,从而调节肝癌的进展。为了研究 circMEMO1 和 miR-106b-5p 之间的直接相互作用,作者设计生物素标记的circMEMO1 探针进行RNA pull down。qRT-PCR 结果显示 miR-106b-5p 在 Huh-7 中被 circMEMO1 探针能够拉下来(图3右上)。生信分析和荧光素酶实验证明,miR-106b-5p靶向Tet家族,通过抑制Tet表达来下调TCF21启动子的5hmC水平,进而抑制TCF21转录(图2左上下)。rescue实验表明TCF21过表达减弱由circMEMO1抑制或miR-106b-5p激活诱导的转移特性和EMT过程(图3右下)。更重要的是,CircMEMO1可以增加肝癌细胞对索拉非尼治疗的敏感性。
技术路线
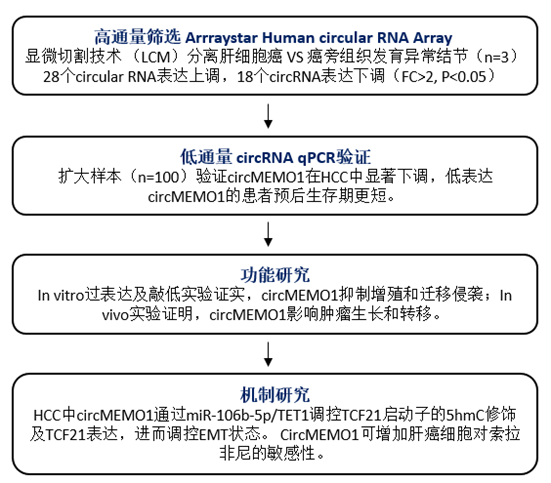
结果展示
circMEMO1在HCC中显著下调并与患者预后相关
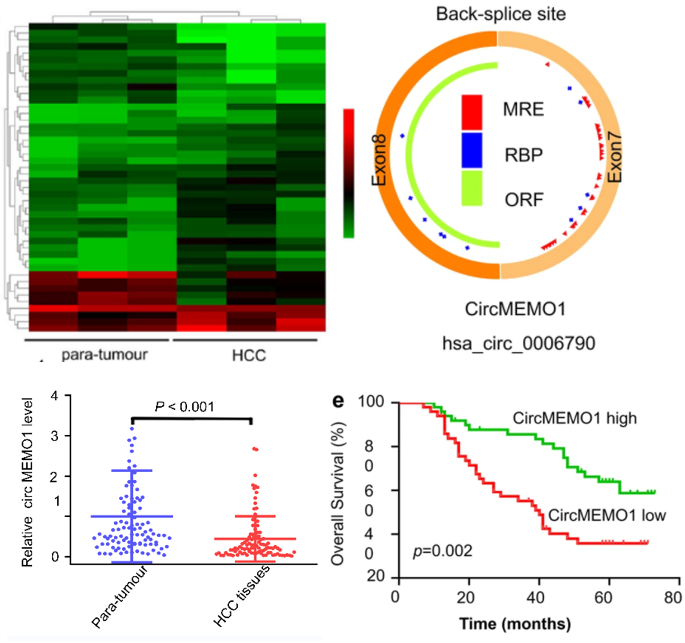
图1. Arraystar Human CircRNA芯片筛选及验证结果
图1:左上:HCC 组织样本中差异表达的 circRNA 与癌旁DN 样本相比的热图。(fold change≥2,p value<0.05,n=3)。右上:circMEMO1 的示意图。左下:qRT-PCR 显示 circMEMO1 表达在 HCC 组织样本中显著下调。右下:Kaplan-Meier 分析表明 circMEMO1 表达下调与预后不良密切相关。
circMEMO1在HCC中抑制增殖和迁移侵袭
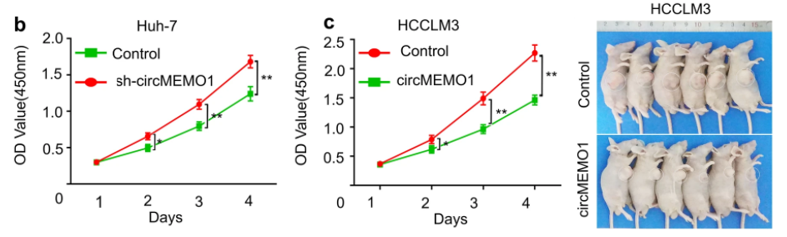
图2:CircMEMO1 在体外和体内抑制 HCC 细胞增殖和侵袭
左图:CCK-8细胞增殖实验证实 circMEMO1 在 HCC 细胞增殖中的作用。右图:过表达CircMEMO1显著抑制移植瘤的体积。
circMEMO1 通过在 HCC 细胞中吸附 miR-106b-5p 来调节 TET/5hmC 轴的水平
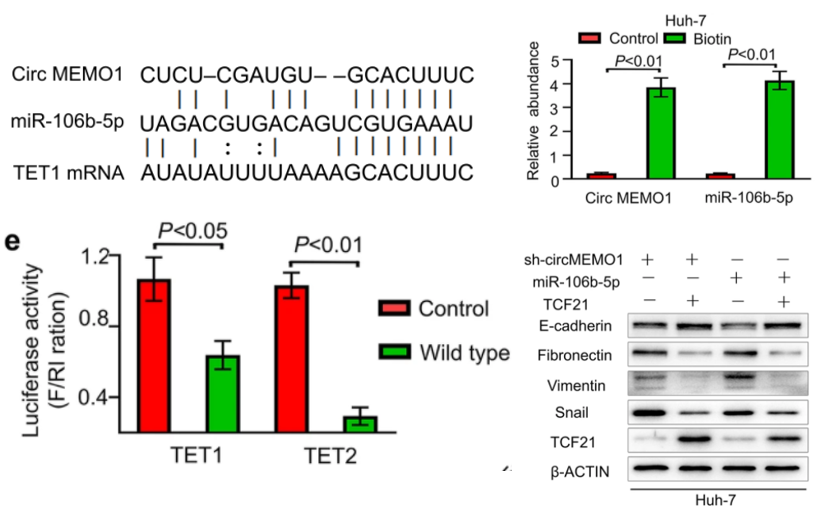
图3:CircMEMO1 通过在 HCC 细胞中吸附 MiR-106b-5p 来调节 TET1/5hmC/TCF21 轴的水平
左上:circMEMO1与miR-106b-5p结合位点示意图,miR-106b-5p与TET1 和 TET2结合位点示意图。右上:circRNA RNA pull down qPCR显示CircMEMO1与mir-106b-5p可以结合。
左下:双荧光素酶报告基因实验证实mir106b-5p与TET1/TET2的3’UTR直接结合。右下:rescue实验表明TCF21过表达减弱由circMEMO1抑制或miR-106b-5p激活诱导的转移特性和EMT过程。
circMEMO1 通过 miR-106b-5p/TET1/5hmC 轴调节 HCC 进展的机制示意图
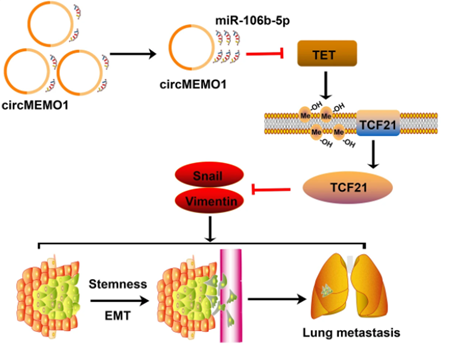
研究意义:
总之,在本研究中作者发现 CircMEMO1在肝癌转移和干细胞分化中是一个重要的肿瘤抑制因子,它通过miR-106b-5p/TET1/5hmC/TCF21轴和EMT过程发挥作用。作为一个关键的表观遗传修饰因子,CircMEMO1还可以调节肝癌细胞对索拉非尼治疗的敏感性。
文章链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-021-01361-3

