

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
G-loop是一种新发现的三维核酸复合结构,由RNA-DNA杂合体(R-loop)与G-四链体(G4)协同形成。当基因组中富含鸟嘌呤的序列折叠形成G4结构时,其互补链会被RNA转录本同源入侵,形成RNA-DNA杂交链,最终构成"G4-RNA杂交体-单链DNA"的三元结构。这一机制首次在《Science》研究中通过非洲爪蟾卵提取物实验和小鼠胚胎干细胞模型得以验证。
一、什么是 G-loop?
当细胞转录富含鸟嘌呤的 DNA 区段时,新生 RNA 会“反客为主”,回侵双链 DNA,与已折叠的 G4 对峙,形成稳定的 RNA-DNA 杂交体——即 G-loop。该过程由经典 DNA 修复因子 BRCA2-RAD51 牵头,hnRNPA1 辅助完成。随后,解旋酶 DHX36、FANCJ 先“拆锁”G4,XPF-ERCC1 内切酶再“剪绳”RNA,DNA 聚合酶补平缺口,整条通路以非损伤方式调用 ATR/ATM 检验点,实现“无痕修复”。
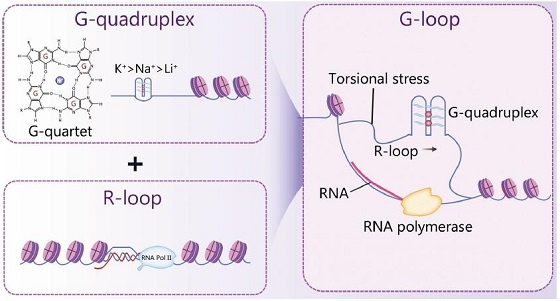
图1. G-四链体(G-quadruplex)结构由富含鸟嘌呤(G)的DNA序列在单价阳离子(稳定能力:K⁺ > Na⁺ > Li⁺)存在下折叠形成,其基本单元是堆叠形成的G-四分体(G-quartets)。 R-loop 是在新生RNA侵入DNA双螺旋时形成的,包含一条RNA-DNA杂交链和一条被置换出的单链DNA(ssDNA)。当RNA-DNA杂交体恰好与一段能形成G-四链体的DNA区域相对时,就会产生一种特殊的结构——G-loop。
二、RNA 浓度 = 分子开关 研究揭示,RNA 的量直接决定 G4 命运:
- 适量 RNA → 促进 G-loop 组装 → G4 被顺利解除;
- 过量 RNA → G-loop 过度稳定 → G4 被“锁死”。
由此形成“转录输出—DNA 构象”即时反馈回路,首次把 RNA 丰度与基因组三维结构动态挂钩。
三、双重安保,护航基因组
细胞为 G4 设置了两道“安全门”:
1. 转录期:RNA 主动“拆弹”,预先清除可能致病的 G4;
2. 复制期:若仍有“漏网之鱼”,DHX36/FANCJ 在复制叉前将其拆解,防止叉停顿与双链断裂。
任何一道门失灵,都会导致 G4/R-loop 积聚,引发转录紊乱、基因组不稳定,甚至细胞癌变或神经元退化。
四、疾病与治疗新视角
BRCA2、FANCJ、XPF-ERCC1 等基因突变常见于乳腺癌、卵巢癌及神经退行性疾病。G-loop 模型首次指出,这些突变除了影响经典 DNA 修复,还可能削弱细胞对“内源结构威胁”的管理能力,成为癌症易感综合征的隐匿元凶。
针对这一通路,科学家提出两大治疗策略:
- 解除“锁死”:开发小分子破坏 G-loop 稳定因子,释放被卡住的 G4;
- 强化“拆弹”:利用 DHX36/FANCJ 抑制剂,在 G4 高负荷肿瘤中制造合成致死效应。
五、未来展望
评论指出,G-loop 研究将引领三大前沿:
1. 3D 基因组学:G-loop 或充当启动子/增强子“锚点”,驱动染色质折叠与转录枢纽形成;
2. 代谢-结构耦合:核苷酸池、转录速率通过 RNA 丰度实时反馈至基因组架构,为“代谢失调-基因组不稳”提供新解释;
3. 神经科学:高转录活性的神经元若 G-loop 解析受损,G4/R-loop 积聚可能触发 ALS、FTD 等病变,亟需深入验证。
通讯作者、伦敦大学学院 De-Chao 教授表示:“这项发现重新定义了‘基因组完整性’——它不仅是修复断裂,更包括对 DNA 二级结构的主动维护。RNA 从幕后走到台前,成为染色质的真正建筑师,未来我们将基于此开发新一代肿瘤与神经退行性疾病干预策略。”
原始文章链接:https://doi.org/10.1186/s40779-025-00683-3
G-loop检测服务
为了更好的协助研究者快速进行G-loop研究,Aksomics公司专门推出了G-loop检测服务,利用G4特异性抗体BG4与R-loop特异性抗体S9.6,结合Cut&tag技术,分别检测体内的G4与R-loop,最后交集获得G-loop信息,助力研究者基因调控与疾病研究中领先一步。欲了解更多详情,请点击下方链接:https://www.aksomics.com/services/r-loop/1814.html

