

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
中山大学附属第一医院运动医学科康焱主任和关节外科张紫机主任长期关注退行性骨关节炎、关节软骨退变与修复的分子机制和临床研究,课题组利用Arraystar m7G small RNA修饰芯片技术,在骨关节炎(Osteoarthritis, OA)软骨细胞中筛选发现了m7G修饰显著上调的tRF:mt-tRF3b-LeuTAA,并且该tRF还有作为骨关节炎疾病治疗靶点的潜力。
细胞实验结果显示, mt-tRF3b-LeuTAA的过表达能上调软骨细胞外基质中分解代谢标志物的表达水平、降低软骨合成标志物的表达,加速OA软骨细胞的退变进程。在对分子机制的研究中,作者发现mt-tRF3b-LeuTAA能靶向结合SUMO特异性水解酶1(SENP1)的mRNA 3’UTR,下调SENP1的表达水平,使其下游靶点SIRT3蛋白的SUMO修饰水平提高,而SUMO修饰能够抑制SIRT3蛋白的去乙酰化酶活性,最终沉默SIRT3蛋白下游PINK1/Parkin通路及其介导的线粒体自噬、破坏正常的能量代谢。在临床研究方面,纳米载体递送的PMC-tRF3b-LeuTAA抑制剂能够显著减轻小鼠软骨退化程度。这些结果确定了mt-tRF3b-LeuTAA对OA退变的关键促进作用,提示这种m7G修饰的新型tRF&tiRNA可能是治疗OA的潜在有效靶点。
该研究成果于2024年发表在学术期刊Biomaterials上,影响因子为12.8 (Arraystar m7G small RNA修饰芯片由康成生物|数谱生物提供技术服务)。

研究背景
骨关节炎(Osteoarthritis, OA)是一种退行性疾病,其特征是软骨下骨重塑、软骨退化、骨赘形成和炎症发生,软骨细胞是广泛存在于各种关节部位的细胞类型,它们的状态改变是骨关节炎发展的关键节点。目前的研究已经证明,药物干预可以预防关节的退化和促进关节炎的修复,OA发生的分子过程中有多种生物学因素参与调控,其中m7G、m6A等RNA表观遗传修饰、尤其是带有各种表观修饰的小RNA是最近研究的一大热点,对骨关节类疾病新治疗靶点的发现和对OA治疗方案的进一步优化具有重要意义。
tRF&tiRNA是一类由tRNA 被各种内切酶切割产生的小非编码RNA,可分为tRF和tiRNA。这些tRF&tiRNA具有多种生物学功能,包括应激反应、干细胞分化、肿瘤发生等,能够参与RNA表达调控、蛋白质翻译后修饰等多种生物学过程。越来越多的研究发现,tRF&tiRNA的表观遗传修饰在各类疾病的发病过程中发挥关键的调控作用,可以通过结合mRNA对蛋白的表达进行抑制,从而间接调控下游基因的表达和相关通路的功能实现。
在这篇文章中,作者发现m7G修饰tRF&tiRNA mt-tRF3b-LeuTAA在骨关节炎软骨细胞有显著表达上调,并且可以通过序列互补配对下调SENP1表达,进而提高其下游靶点SIRT3蛋白的SUMO化水平并抑制其去乙酰化酶活性,导致线粒体膜电位下降和氧化应激增加、PINK1在线粒体外膜上的积累减少、无法有效激活Parkin,最终使得线粒体自噬过程受阻、OA细胞中ROS和乳酸累积。此外,关节内注射PMC-tRF3b-LeuTAA抑制剂可以减轻小鼠软骨退化,表明mt-tRF3b-LeuTAA可能是OA的潜在治疗靶点。
总的来说,这篇文章揭示了mt-tRF3b-LeuTAA在骨关节炎中的重要作用,并提出了通过靶向该分子轴来治疗骨关节炎的可能性。mt-tRF3b-LeuTAA可通过抑制SENP1蛋白表达间接抑制线粒体自噬过程,这些结果为tRF&tiRNA调控线粒体功能和软骨细胞退变的机制提供了新的见解,也为优化创新OA治疗方案提供了可靠的研究基础。
研究思路
文章着重于研究tRF&tiRNA mt-tRF3b-LeuTAA对OA软骨细胞在骨关节炎退变发生过程中的调控机制。作者首先通过高通量测序发现tRNA m7G修饰酶Mettl1在OA退变细胞中相比正常细胞有表达水平的显著上调,且细胞整体m7G修饰水平也有显著提高。通过运用Arraystar m7G small RNA修饰芯片,作者在Mettl1敲除和对照细胞中筛选得到了具有m7G修饰水平显著变化的tRF分子mt-tRF3b-LeuTAA。在体内外实验中,作者证明了mt-tRF3b-LeuTAA的过表达能够加速和增强OA软骨细胞的退变过程;同时通过靶基因预测发现SUMO特异性水解酶1(SENP1)的mRNA 3’UTR区域能作为mt-tRF3b-LeuTAA下游结合的靶点;因此OA退变过程中SENP1蛋白的表达水平有显著下调,导致下游靶点SIRT3蛋白的SUMO修饰水平提高,异常沉默了SIRT1的去乙酰化酶活性,最终抑制了下游PINK1/Parkin通路的活性及其介导的线粒体自噬过程,破坏了正常的能量代谢,使细胞积累大量的ROS和乳酸、发生退行性变。前瞻性临床研究结果显示,将mt-tRF3b-LeuTAA的小分子抑制剂利用纳米载体注射到OA模型小鼠的患病关节处,能够显著减轻小鼠软骨退化程度,这些结果都表明mt-tRF3b-LeuTAA在OA发生和恶化过程中扮演了重要的角色。
在功能研究中,作者发现过表达或抑制Mettl1能够显著提高或降低原代人OA细胞的m7G整体修饰水平,并影响软骨细胞增殖、凋亡以及合成代谢和分解代谢标志物的表达。抑制mt-tRF3b-LeuTAA将使OA细胞退行变性程度显著减弱,说明mt-tRF3b-LeuTAA的高表达与OA细胞的退行变性密切相关。
在机制研究中,作者利用靶基因预测和双荧光素酶实验发现mt-tRF3b-LeuTAA能够靶向结合SENP1 mRNA 3’UTR区域,导致SENP1表达受到抑制,从而提高下游蛋白SIRT3的SUMO化修饰水平、沉默PINK1/Parkin通路,最终导致线粒体自噬异常,ROS、乳酸等有害代谢物堆积、细胞退变发生。总之这些结果表明,带有m7G修饰的新型tRF&tiRNA mt-tRF3b-LeuTAA能够通过影响SENP1蛋白的功能来激活软骨细胞退变的关键进程。
技术路线

结果展示
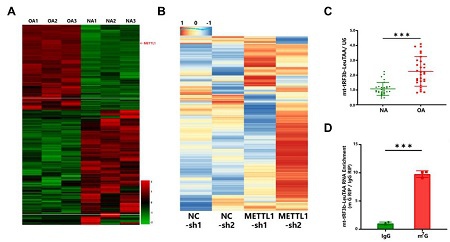
图1:mt-tRF3b-LeuTAA参与软骨细胞退变过程。
A RNA测序结果显示Mettl1在OA退变软骨细胞中表达水平显著上调;
B Arraystar m7G small RNA修饰芯片结果显示,敲低m7G修饰酶 Mettl1之后,tRF&tiRNA m7G修饰水平有显著差异;
C qPCR验证mt-tRF3b-LeuTAA在OA退变细胞中的表达水平;
D m7G-MeRIP-PCR验证mt-tRF3b-LeuTAA在OA退变软骨细胞中的m7G修饰水平。
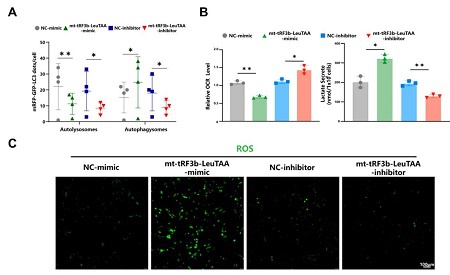
图2:功能实验,mt-tRF3b-LeuTAA促进软骨细胞退变。
A 敲低、过表达mt-tRF3b-LeuTAA显著影响OA细胞的凋亡和自噬;
B 敲低、过表达mt-tRF3b-LeuTAA显著影响细胞耗氧率和乳酸代谢水平;
C 免疫荧光成像显示mt-tRF3b-LeuTAA显著影响细胞内ROS的积累。
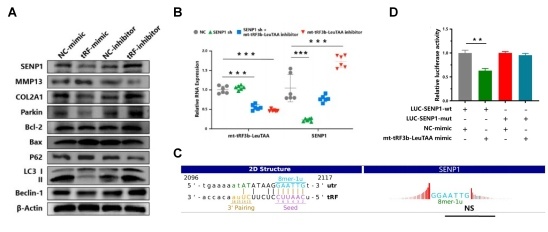
图3:机制研究1,mt-tRF3b-LeuTAA靶向结合SENP1 mRNA。
A 过表达、敲低mt-tRF3b-LeuTAA影响SENP1蛋白的表达水平;
B mRNA-qPCR验证mt-tRF3b-LeuTAA抑制SENP1 mRNA表达;
C靶基因预测显示mt-tRF3b-LeuTAA能够结合SENP1 mRNA 3’UTR区域;
D双荧光素酶实验验证mt-tRF3b-LeuTAA与SENP1的结合。
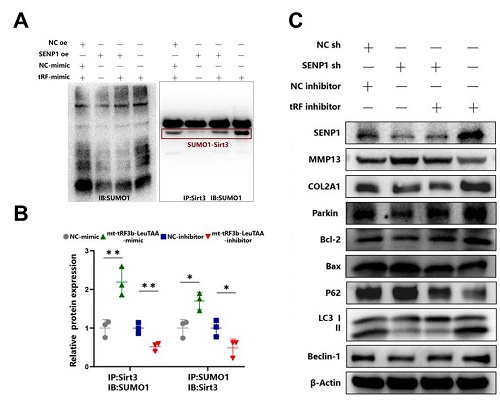
图4:机制研究2,SENP1影响下游蛋白SIRT3的SUMO修饰水平和PINK1/Parkin通路相关蛋白的表达。
A 过表达SENP1导致SIRT3蛋白的SUMO修饰水平显著下调;
B 过表达、敲低mt-tRF3b-LeuTAA影响SIRT3的表达和SUMO修饰水平;
C 敲低SENP1或mt-tRF3b-LeuTAA显著影响PINK1/Parkin通路蛋白的表达水平。
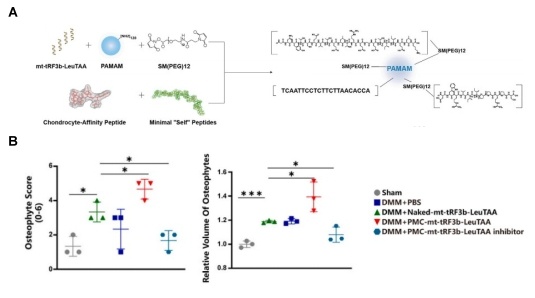
图5:机制研究3,纳米颗粒包被的mt-tRF3b-LeuTAA抑制剂能有效减轻小鼠OA退变程度。
A包被mt-tRF3b-LeuTAA抑制剂纳米颗粒的组装流程;
B mt-tRF3b-LeuTAA抑制剂直接注射OA模型小鼠的患病关节能够显著回复软骨退变程度。
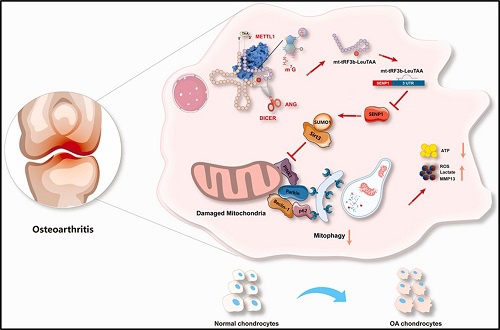
图6:作用机制图。
mt-tRF3b-LeuTAA与SENP1 mRNA特异性结合并抑制SENP1蛋白表达,从而上调SIRT3的SUMO化修饰水平,沉默下游PINK1/Parkin通路,导致线粒体自噬功能异常、有害代谢物积累,最终使软骨细胞发生病变。
研究意义
本研究通过利用Arraystar m7G small RNA修饰芯片在Mettl1敲低OA退变软骨细胞模型细胞中进行筛选,发现带有m7G修饰的tRF&tiRNA分子mt-tRF3b-LeuTAA表达水平显著降低,并通过一系列实验表明mt-tRF3b-LeuTAA通过ceRNA机制结合SENP1 mRNA 3’UTR,导致线粒体功能破坏,加速软骨细胞的退行性变过程,而在小鼠OA疾病模型中,直接注射mt-tRF3b-LeuTAA的小分子抑制剂能够显著减轻关节炎病变情况,对未来临床应用具有优越的实践价值。这些发现深入研究了tRF&tiRNA分子mt-tRF3b-LeuTAA在OA发病过程中的重要作用,并为OA的精准治疗提供了新的靶点。
原文出处
https://www.sciencedirect.com/science/article/abs/pii/S014296122400437X?via%3Dihub
康成生物丨数谱生物可提供的相关技术服务
Arraystar mRNA&lncRNAArraystar m7G small RNA修饰芯片
m7G tRF&tiRNA qPCR验证
