

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
近期,哈尔滨医科大学附属第二医院孙亚男教授发表名为“RBM15 facilitates laryngeal squamous cell carcinoma progression by regulating TMBIM6 stability through IGF2BP3 dependent”的研究性论文。该论文应用Arraystar Human m6A mRNA & lncRNA表观转录组芯片发现,RBM15通过对TMBIM6进行m6A修饰,使TMBIM6的mRNA稳定性上升,最终促进喉鳞状细胞癌的发生发展。该研究成果于2021年2月发表在国际著名学术期刊《Journal of Experimental & Clinical Cancer Research》(IF: 7.1)上。(m6A表观转录组芯片由康成生物丨数谱生物提供技术服务)

研究背景
作为目前的热门研究领域之一,RNA的表观修饰吸引了大量研究者的目光,在这一领域中,m6A修饰是研究最多的一类。这一修饰的特征是在核糖核苷酸的A碱基上添加一个甲基基团,进而影响对应RNA分子的功能。已知和m6A修饰相关的蛋白主要可以分为三类,首先,writer蛋白负责将修饰添加到RNA分子上,这类蛋白包括Mettl3、RBM15等。其次,eraser蛋白负责将修饰从RNA分子上去除,主要包括ALKBH5、FTO等蛋白。最后,reader蛋白能够识别RNA分子上的m6A修饰,进一步与该分子结合后发挥相应的调控功能,例如IGF2BP家族蛋白使得RNA分子更加稳定,YHTDF1促进mRNA翻译等等。
喉鳞状细胞癌作为一类常见的恶性肿瘤,每年可造成我国约三万人患病。其主要症状包括咳血,咳痰,颈部淋巴结转移等。关于喉鳞状细胞癌的治疗,目前虽然发展了多种治疗方法,但这些方法对于患者五年期生存率并没有显著的改善。因此,开发新的有效治疗方法,提高患者的生存率便显得尤为重要。
本次研究系统地探讨了m6A修饰在喉鳞状细胞癌中的作用,发现了喉鳞状细胞癌中与m6A修饰相关的一系列蛋白以及其作用机制,对于后续相关疾病的治疗,开发新型治疗方法具有重要的参考价值和指导意义。
研究思路
预实验发现RBM15与喉鳞状细胞癌相关
为了研究影响喉鳞状细胞癌(LSCC)发生发展的相关因素。作者首先检测了LSCC患者的癌组织以及癌旁组织,发现在癌组织中m6A水平有显著上调。据此,作者通过PCR等实验找到了在癌组织中显著上调的m6A修饰酶基因RBM15。随后,作者在细胞以及小鼠模型中过表达或敲低RBM15,发现RBM15能够显著促进肿瘤的生长。
Arraystar Human m6A mRNA & lncRNA表观转录组芯片筛选
由于m6A修饰主要通过影响下游的靶基因来发挥功能,在已有文献里面这部分内容也是大家讨论的重点部分。因此作者接下来就采用了Arraystar Human m6A mRNA & lncRNA表观转录组芯片对下游的靶基因进行筛选。通过比较野生型LSCC细胞与敲低RBM15的LSCC细胞间的差异m6A修饰基因,作者找到了TMBIM6。通过MeRIP-PCR等实验,作者发现RBM15能够提高TMBIM6的m6A修饰水平,并且RBM15也可以提高TMBIM6的mRNA水平,表明RBM15可能通过调控TMBIM6的表达水平来发挥功能。
TMBIM6功能研究
为了进一步确定TMBIM6在LSCC发生发展中的作用,作者研究了TMBIM6的功能。通过transwell小室等实验,作者发现TMBIM6能够促进LSCC细胞的侵袭能力。在小鼠层面的研究则发现TMBIM6能够促进肿瘤的产生,说明TMBIM6与LSCC的发生发展具有密切关系。
机制研究
为了研究TMBIM6下游的reader蛋白,首先作者根据文章前半部分的工作,发现m6A修饰酶RBM15的敲低与TMBIM6的mRNA水平下降可能相关。而已有文献表明,与m6A修饰相关的reader蛋白中,IGF2BPs家族蛋白能够提高mRNA的稳定性。据此,作者通过检测表达水平的变化最终找到了IGF2BP3。接下来作者通过RIP等实验发现,m6A修饰的TMBIM6能够与IGF2BP3结合,过表达IGF2BP3则能够提高TMBIM6的mRNA稳定性,导致相应mRNA表达量上升。随后通过MazF PCR等实验验证了TMBIM6上m6A修饰位点的存在(GGACA),将该修饰位点突变之后,IGF2BP3就不能发挥相应的功能,表明IGF2BP3提高TMBIM6的mRNA稳定性的功能依赖于该修饰位点。最后,功能研究表明,IGF2BP3也具有类似的促癌效果,进一步证实了m6A对于喉鳞状细胞癌的促进作用。
技术路线
结果展示
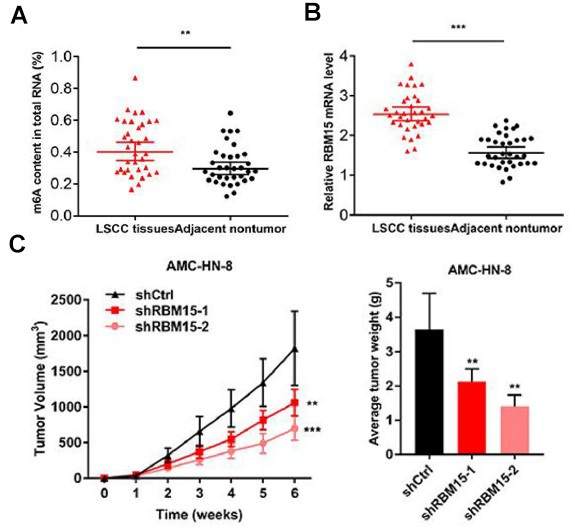
图1. 预实验发现RBM15与喉鳞状细胞癌相关
A:LSCC癌组织中m6A总量高于癌旁组织。B:PCR实验发现LSCC癌组织中RBM15表达量高于癌旁组织。C:小鼠成瘤实验表明,敲低RBM15抑制肿瘤生长。
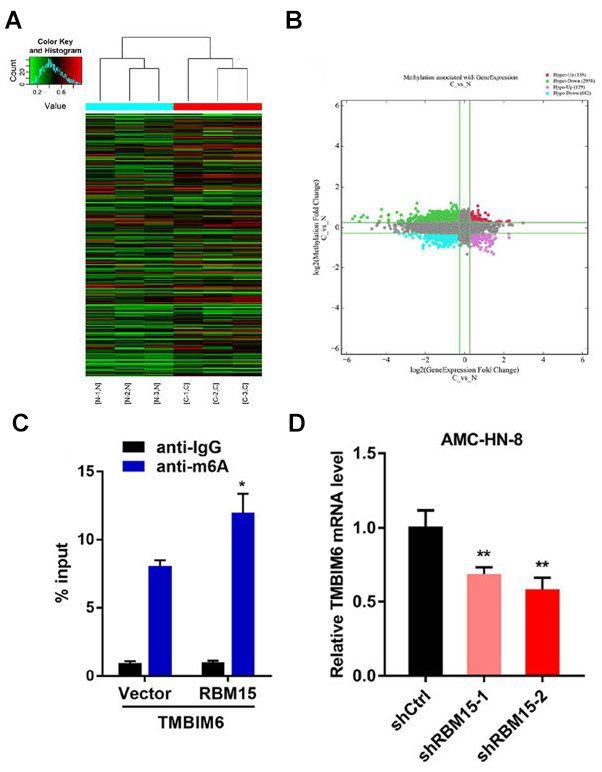
图2. Arraystar Human m6A mRNA & lncRNA表观转录组芯片筛选
A:敲低RBM15前后差异m6A修饰表观转录组芯片结果聚类图(实验组与对照组各3个样本)。B:四象限图展示在实验组与对照组的比较中,m6A修饰量以及转录本表达量均有变化的mRNA。C:MeRIP-PCR实验发现,在LSCC的细胞系中TMBIM6被m6A修饰,同时过表达RBM15能够进一步提高TMBIM6的m6A修饰水平。D:PCR实验发现,相比于野生型细胞,敲低RBM15的细胞中TMBIM6表达量更低。
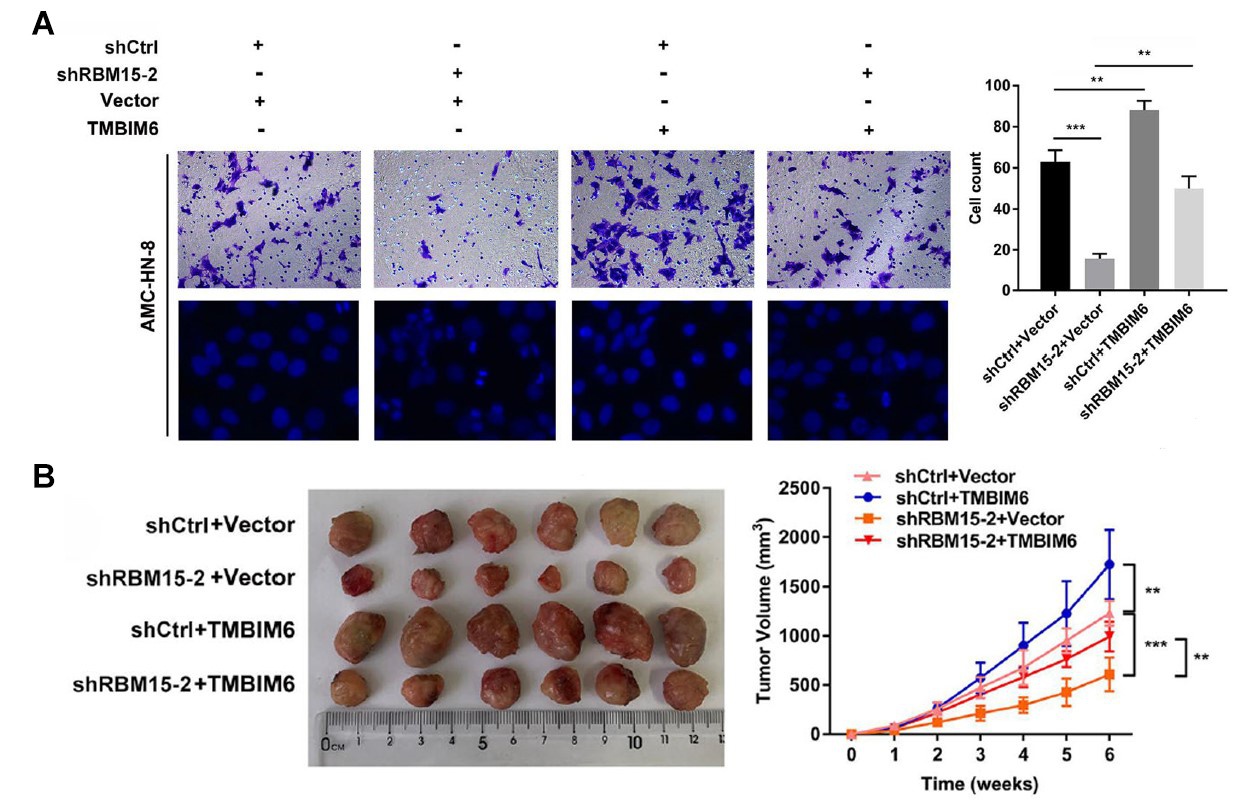
图3. TMBIM6功能研究
A:Transwell小室实验发现TMBIM6能够促进癌细胞的迁移和侵袭。B:小鼠成瘤实验表明TMBIM6能够促进肿瘤生长。
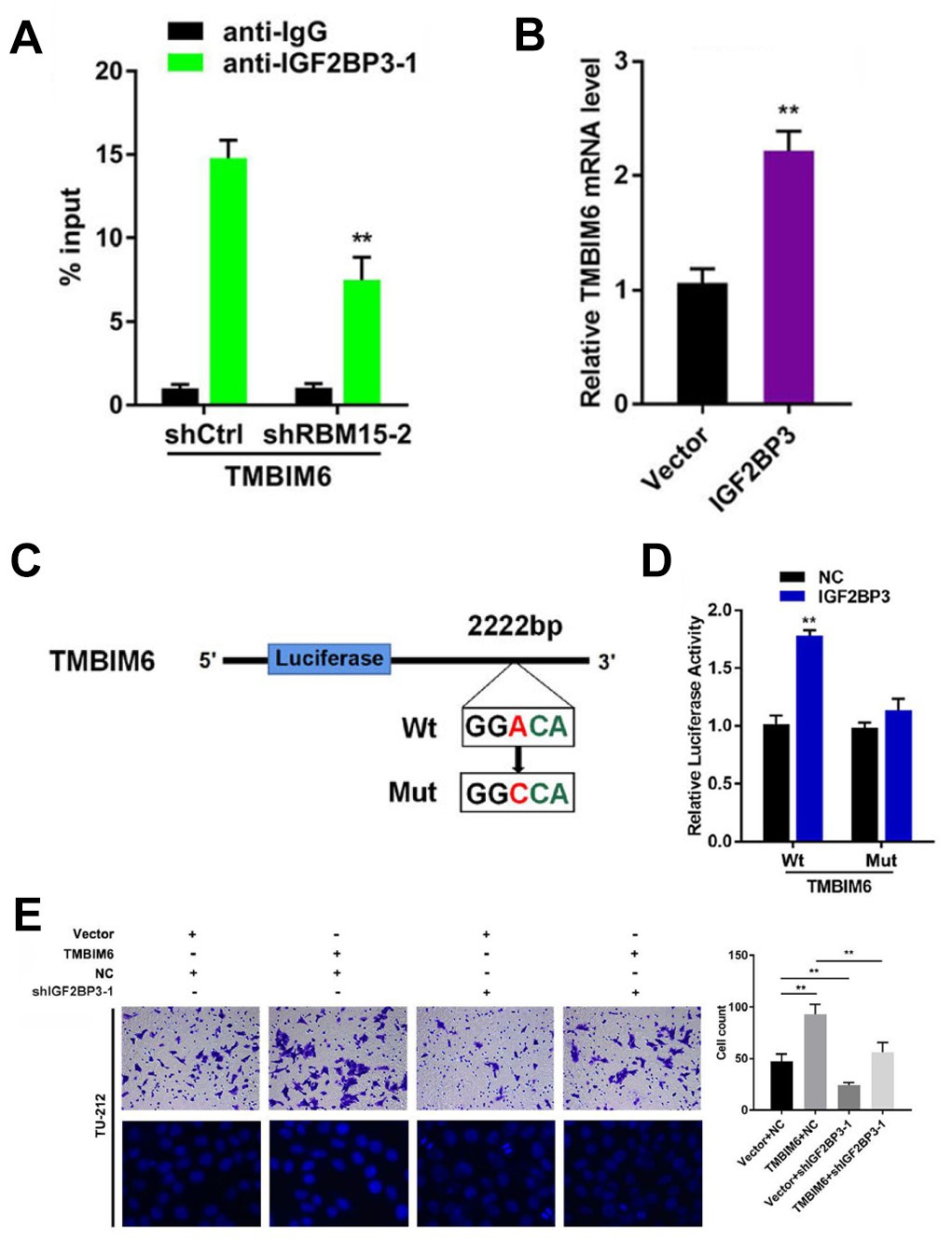
图4. 机制研究
A:RIP-PCR实验发现IGF2BP3能够与TMBIM6结合,敲低RBM15会抑制它们的结合。B:PCR实验表明,过表达IGF2BP3能够导致TMBIM6的mRNA水平升高。C:利用MazF PCR验证,找到TMBIM6的m6A修饰位点(GGACA),并据此设计位点突变实验。D:双荧光素酶实验发现IGF2BP3促进TMBIM6的mRNA稳定性的功能依赖于MazF PCR检测到的m6A修饰位点。E:Transwell小室实验表明,IGF2BP3敲低会抑制肿瘤细胞的迁移与侵袭。
研究意义:
在发现RBM15调控喉鳞状细胞癌内的m6A水平后,作者通过Arraystar Human m6A mRNA & lncRNA表观转录组芯片进行筛选,找到了受RBM15调控的靶基因TMBIM6。功能研究发现,TMBIM6在细胞和小鼠层面上都能够促进癌症的发生发展。进一步的机制研究表明,TMBIM6的m6A修饰能够帮助招募IGF2BP3,并且作者通过MazF PCR等实验在单碱基水平上鉴定出影响二者结合的m6A修饰位点。IGF2BP3能够提高TMBIM6的mRNA稳定性,促进TMBIM6的表达,从而促进癌症的发生发展。总体而言,这项工作思路清晰,数据详实,具有很高的科研价值与应用价值,为喉鳞状细胞癌的治疗提供了新的思路与方法。
文章链接:
https://jeccr.biomedcentral.com/articles/10.1186/s13046-021-01871-4
相关技术服务
Arraystar m6A-mRNA&lncRNA表观转录组芯片

