

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
已有研究表明,Small RNA被不同化学基团所修饰,这些化学基团一方面能够调控small RNA的活性,另一方面也可以赋予它们新的功能。已知这些RNA修饰通过多种分子机制来发挥功能,如RNA修饰可以改变miRNA的靶向性或改变tsRNA(tRF&tiRNA)与RNA结合蛋白的亲和力,进而发挥生物活性等。Small RNA修饰谱分析是表观转录组学研究的新前沿,具有重要的科学意义和临床价值。
miRNA种子区(第2-8位碱基)的修饰可以改变miRNA抑制的靶基因。例如,O8G修饰的miR-184会发生重定向,进而特异性的靶向到原本序列不匹配的Bcl-xL和Bcl-w,并抑制其翻译(图1)[1]。在另一个案例中,在使用肾上腺素能激动剂处理后,O8G修饰增多的miR-1重定向到一群在心肌肥大通路中起作用的新靶点[2]。事实上,在病理条件下,对miRNAs的O8G修饰是一种普遍的表观转录机制,是ROS微调基因表达的氧化还原信号通路的一部分[2, 3]。
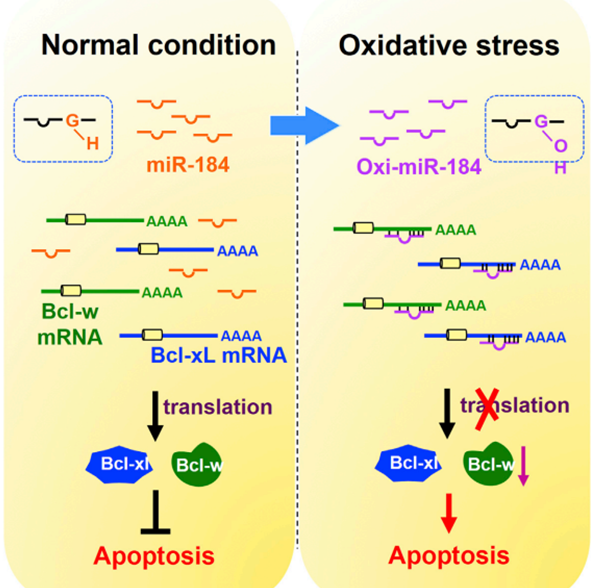
图1、 O8G修饰的miR-184重定向到不匹配的Bcl-xL和Bcl-w mRNA从而发挥靶向功能,抑制相应抗凋亡蛋白的翻译,从而导致心脏对心肌缺血/再灌注(I/R)损伤的敏感性增强。
修饰small RNA可以诱捕RNA结合蛋白(RBP),从而抑制RBP与靶mRNA的结合,通过这种修饰依赖的方式调控基因表达。例如,tsRNA上的5 '端寡聚鸟嘌呤(TOG),在其8号位碱基处可以是未修饰的尿苷(U8),或者是被PUS7修饰的假尿苷(Ψ8)。U8/Ψ8状态决定了其与作为翻译起始因子的聚腺苷酸结合蛋白1 (PABPC1)的不同结合亲和力。Ψ8-TOG-5’tsRNAs与PABPC1结合更紧密,将其从mRNA上取代下来,从而抑制对应mRNA的翻译,而U8-TOG-5’ tsRNAs则没有这种能力(图2)[4]。
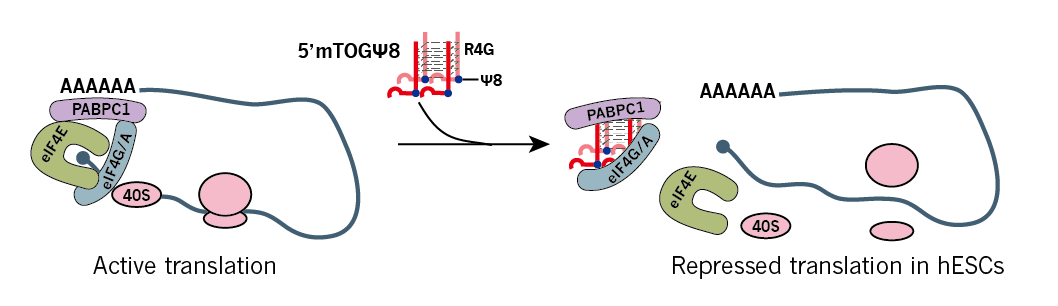
图2、 8号位碱基带有Ψ修饰的5'TOG-tsRNAs诱捕并使PABPC1从翻译起始复合物中脱离,从而抑制带帽mRNA的翻译[4]。
[1] Wang, J. X., et al. (2015) "Oxidative Modification of miR-184 Enables It to Target Bcl-xL and Bcl-w" Mol Cell 59(1):50-61 [PMID: 26028536]
[2] Seok, H., et al. (2020) "Position-specific oxidation of miR-1 encodes cardiac hypertrophy" Nature 584(7820):279-285 [PMID: 32760005]
[3] Seok, H., et al. (2016) "MicroRNA Target Recognition: Insights from Transcriptome-Wide Non-Canonical Interactions" Mol Cells 39(5):375-81 [PMID: 27117456]
[4] Guzzi, N., et al. (2018) "Pseudouridylation of tRNA-Derived Fragments Steers Translational Control in Stem Cells" Cell 173(5):1204-1216 e26 [PMID: 29628141]
相关服务:

