

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
中山大学孙逸仙纪念医院苏士成教授、许小丁教授与中山大学附属第三医院高志良教授合作,在非酒精性脂肪性肝炎领域发表了题为“Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output”的研究性论文。该论文应用Arraystar Human CircRNA芯片筛选鉴定出与非酒精性脂肪性肝炎发生相关的环状RNA分子SCAR,功能研究表明,在线粒体中过表达circRNA SCAR会抑制肝脏成纤维细胞的活化并抑制相应的炎症反应,敲低则有相反的表型。机制研究发现,由脂质暴露引发的内质网应激(ER stress)会上调CHOP的表达,CHOP通过抑制PGC-1α的转录从而导致线粒体中circRNA SCAR表达量的下降。circRNA SCAR表达量的下降使得原本与其结合的ATP5B转而与CypD结合导致mPTP通道开放。开放的mPTP通道能够使线粒体中的ROS释放到细胞质中,而ROS作为一类活性氧物质能够增强肝脏成纤维细胞的促炎能力从而导致肝脏炎症的加重。总体而言,该研究解决了非酒精性脂肪性肝炎发生发展机制的重要问题,发现了线粒体circRNA的重要功能并发展了一系列相关的实验方法,为后续研究奠定了基础并指明了方向。该研究成果于2020年10月发表在国际著名学术期刊Cell (IF: 38.637)上。(芯片实验由康成生物丨数谱生物提供技术服务)

研究背景
非酒精性脂肪性肝炎(NASH)属于脂肪肝病的一种,相比于单纯性肝脂肪变性,该病引发的肝损伤更加严重,患者易于出现肝纤维化并引发相关肝脏疾病如肝硬化甚至肝癌的产生。据报道称,非酒精性脂肪性肝炎的全球患病率大约在3%-5%。因此,对该病的研究具有重要的科学意义和应用价值。
环状RNA(circRNA)是一类将线性RNA分子的3’端和5’端通过反向剪切共价连接形成的环状RNA分子,可以由外显子、内含子或者同时包含这两种序列的片段组成。与线性分子相比,这种环形的结构可提高环状RNA的稳定性。环状RNA发挥功能主要有四种机制:1、环状RNA可以通过吸附miRNA发挥ceRNA机制。2、环状RNA可以结合特定的蛋白,调控靶蛋白的功能。3、某些环状RNA具有潜在的翻译能力,能够产生具有活性的短肽。4、环状RNA能够结合DNA影响基因的表达。
技术路线

研究思路
1. CircRNA高通量筛选及临床数据研究
为了研究影响非酒精性脂肪性肝炎(NASH)发生的具体机制,作者选取了四份NASH患者肝成纤维细胞样本,通过与正常样本进行对比,采用Arraystar Human CircRNA芯片筛选了差异倍数大于2,P值小于0.05的指标(图1A)。由于ROS的主要来源是线粒体,故作者重点寻找了线粒体定位的环状RNA,最终找到在NASH患者肝成纤维细胞线粒体中表达下调的环状RNA分子SCAR(图1B),并通过RNase R消化、免疫荧光等实验验证了这一点(图1C)。进一步,通过对临床数据的分析,结果表明肝成纤维细胞中环状RNA分子SCAR的水平与其细胞内ROS含量呈反比且和整体肝脏健康程度呈正相关关系(图1D),表明SCAR确实可能与NASH的发生相关。
2. 功能研究
为了证实环状RNA分子SCAR具有引发NASH的功能,作者在肝成纤维细胞线粒体中过表达了这一环状RNA。通过ELISA等实验表明,过表达SCAR后,肝成纤维细胞内从线粒体释放到细胞质中的ROS量明显减少(图2A),并且能够抑制肝成纤维细胞的活化以及炎症因子的释放(图2B、2C、2D)。此外,敲低该分子则有相反的表型。除了细胞实验外,作者在小鼠模型上通过免疫组化等实验发现过表达SCAR使肝部浸润巨噬细胞减少(图2E)。因此,SCAR确实具有抑制NASH的能力并具有潜在的治疗价值。
3. 机制研究
进一步的,针对SCAR引发NASH的下游机制这一问题。首先作者通过RNA pull down与质谱联用的方式找到了SCAR的结合蛋白ATP5B并确定了它们间的结合区域(图3A、3B)。已有文献表明,ATP5B作为线粒体上mPTP通道的组成蛋白之一,可以影响该通道的开放程度,因此作者利用IP等技术深入研究了SCAR对于mPTP通道的影响。结果发现:环状RNA分子SCAR能够阻碍CypD蛋白结合ATP5B,从而导致mPTP通道无法开放(图3C)。因此,在SCAR表达量减少的情况下,mPTP通道能够被CypD结合并开启,从而使得线粒体内的ROS释放到细胞质中(图3D),进而导致肝成纤维细胞的细胞因子释放减少(图3E)。
最后,作者进一步研究了调控SCAR表达量的上游机制。通过CLIP-seq、RIP及q-PCR实验表明,肝成纤维细胞在脂质暴露的情况下发生的内质网应激(ER stress)导致CHOP蛋白表达量下降,进一步使PGC-1α表达量下降(图4A),PGC-1α通过调控转录(图4B),从而最终使得SCAR的表达降低(图4C)。
结果展示
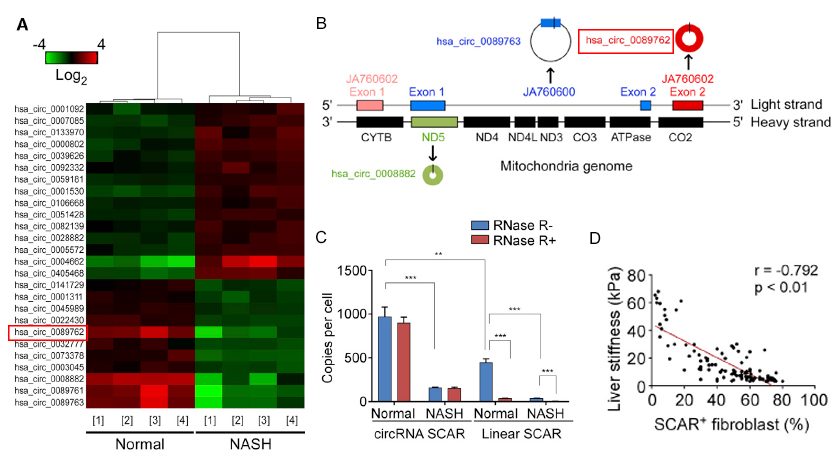
图1. Arraystar Human CircRNA芯片筛选及验证结果。
A:差异circRNA聚类图(FC≥2,P<0.05,n=4),在NASH模型病人中找到一个明显下调的环状RNA分子SCAR(hsa_circ_0089762)。B:SCAR对应在线粒体基因组上的位置(以红框标注)。C:Rnase R处理后,Q-PCR验证SCAR的环状结构以及SCAR在NASH患者中的表达情况。D:NASH患者肝脏硬度与SCAR成纤维细胞数目的相关性分析。
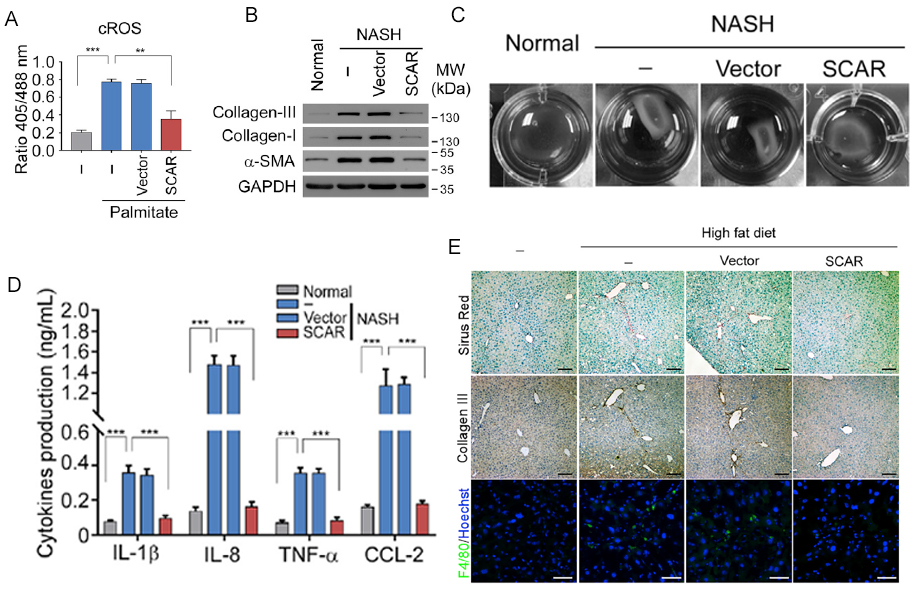
图2. 过表达SCAR抑制NASH相关表型。
A:正常肝成纤维细胞在使用棕榈酸酯模拟脂质暴露的情况下,过表达SCAR对于细胞质中ROS(cROS)含量的影响。B:Western blot检测过表达SCAR对于NASH患者肝成纤维细胞活化的影响。C:过表达SCAR对NASH患者肝成纤维细胞收缩性的影响。D:过表达SCAR后NASH患者肝成纤维细胞释放的细胞因子总量变化情况。E:在高脂喂养小鼠模型中,过表达SCAR导致肝组织中浸润的巨噬细胞减少。
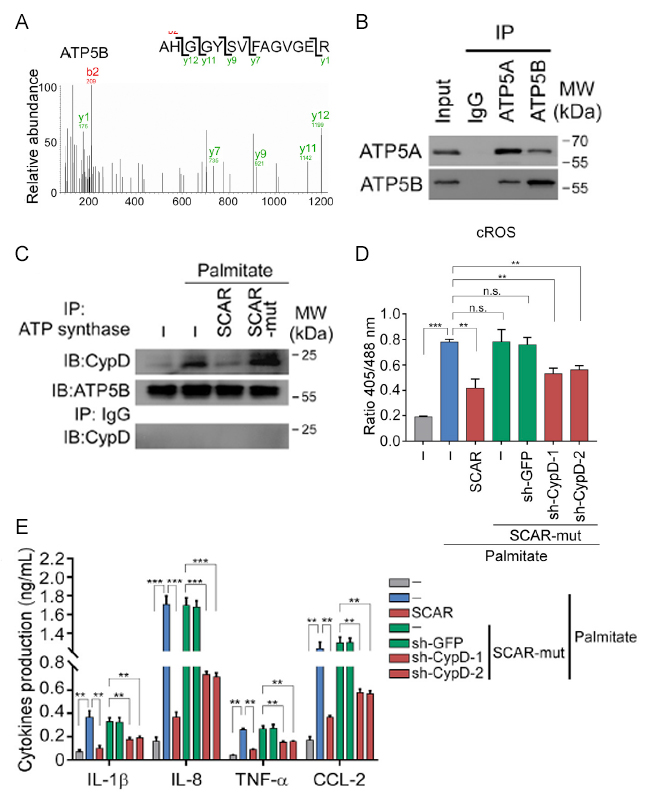
图3. SCAR发挥功能的下游机制。
A:RNA pull down以及质谱检测SCAR结合蛋白。B:RIP实验鉴定ATP5B与SCAR的结合情况。C:SCAR影响CypD与ATP5B的结合。D:SCAR与CypD对于肝成纤维细胞的细胞质中ROS释放的影响。E:ELISA检测SCAR与CypD对于肝成纤维细胞释放细胞因子的影响。
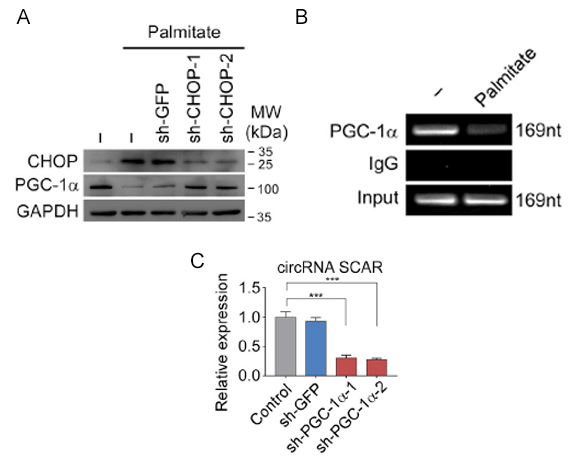
图4. 调控SCAR表达量的上游机制。
A:棕榈酸酯模拟脂质暴露的情况下,CHOP表达量上升,PGC-1α表达量下降,敲低CHOP蛋白后PGC-1α表达量降低。B:ChIP实验分析棕榈酸酯处理下PGC-1α与SCAR启动子区结合情况。C:PGC-1α敲低抑制SCAR表达。
研究意义
作者利用Arraystar Human CircRNA芯片在NASH患者肝成纤维细胞中找到了影响NASH发生发展的线粒体定位环状RNA分子SCAR,在临床样本验证中发现SCAR的表达与人体肝脏健康程度显著相关。细胞层面上的功能研究表明SCAR与线粒体ROS释放相关,并且能够抑制肝成纤维细胞的活化以及炎症因子的释放,而小鼠模型上的研究则表明SCAR能够减轻肝硬化的表型。最后作者通过一系列的机制实验研究发现,在脂质暴露的情况下出现的内质网应激会导致CHOP及其下游PGC-1α的减少,进而导致SCAR的表达量下降。SCAR的减少会导致原本与其结合的ATP5B转而与CypD结合,从而使线粒体上mPTP通道开放并将ROS释放到细胞质中最终引起NASH。总体而言,这项工作思路清晰,数据详实,具有很高的科研价值与应用价值,为NASH的治疗提供了新的思路与方法。
文章链接
https://linkinghub.elsevier.com/retrieve/pii/S0092-8674(20)31000-X
相关服务

