

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
海军军医大学附属东方肝胆外科医院信号转导研究中心主任王红阳院士课题组采用Arraystar circRNA表观芯片筛选发现,携带m6A修饰的环状RNA分子circTACC3在代谢功能障碍脂肪性肝炎(MASH)相关肝细胞癌(HCC)中显著上调,并通过MeRIP-PCR实验进行了验证。进一步研究发现,circTACC3在脂质过载条件下与非POU结构域八聚体结合蛋白(NONO/p54nrb)直接相互作用,组装成核内旁斑,这一过程依赖于circTACC3的m6A修饰。
circTACC3的生物学功能研究表明,在脂质过载条件下,m6A修饰的circTACC3显著影响肿瘤细胞的细胞内脂质积累、生长和环境适应性生存。机制上,circTACC3形成的旁斑被招募到DNA断裂位点(DSB),形成DSB-circTACC3-R-loop。这些R-loop进一步促进拓扑关联域(TAD)的接触和融合,并选择性激活与MASH相关HCC恶性表型相关的基因。总之,这项研究揭示了m6A修饰的circTACC3在MASH相关HCC中的关键作用,为开发针对MASH相关HCC的新型诊断标志物和治疗策略提供了理论基础。
该研究成果于2025年发表在学术期刊Cancer Communications上,影响因子为24.9(Arraystar circRNA表观芯片由康成生物|数谱生物提供技术服务)。

研究背景
代谢功能障碍相关脂肪性肝炎(MASH)是代谢相关脂肪性肝病的严重表现形式,预计到2030年将成为肝细胞癌(HCC)的主要病因。MASH相关HCC具有独特的分子和免疫特征,影响其进展和治疗效果。研究表明,N6-甲基腺苷(m6A)修饰的circRNA在肿瘤恶性进展中起关键作用,但其在MASH相关HCC中的具体机制尚不清楚。这篇文章中,作者发现m6A修饰的环状RNA circTACC3在MASH相关的HCC中高表达。在脂质过载条件下,m6A修饰的circTACC3形成核内旁斑,并被招募至DNA损伤区域形成R-loop结构,导致染色质重塑和MASH相关肝细胞癌恶性表型相关的基因的选择性激活,促进癌症进展,为开发新的肝癌治疗靶点提供了科学依据。
研究思路
文章着重于研究m6A修饰的circRNA在MASH相关HCC中的作用及其调控网络,并探讨circRNA如何响应脂质过载应激以驱动MASH相关HCC的恶性进展。作者首先运用Arraystar circRNA表观芯片技术检测发现携带m6A修饰的circTACC3在MASH相关肝细胞癌中高表达,并通过MeRIP-PCR等试验进行了验证。核质分离与3D-FISH等试验表明circTACC3主要定位于细胞核。
功能研究上,作者使用3D类器官培养技术和多种肝细胞癌细胞系,通过棕榈酸(PA)和油酸(OA)处理来模拟脂质过载条件,发现脂质过载导致细胞核circTACC3的水平显著升高,并显著影响肿瘤细胞的细胞内脂质积累、生长和环境适应性生存。circTACC3敲除或m6A修饰干预均可逆转这些恶性表型。
在机制研究中,作者通过meRIP-qPCR发现m6A修饰circTACC3主要定位于细胞核,m6A抑制剂处理显著减少了脂质过载诱导的circTACC3细胞核定位。作者进一步通过circRNA pulldown和LC-MS实验(circRNA CHIRP–MS)发现circTACC3与非POU结构域八聚体结合蛋白(NONO/p54nrb)结合,该结果在RIP-PCR、FLIM-FRET和荧光共定位实验中也得到了证实。这些结果综合表明,脂质过载条件下,m6A促进circTACC3定位于细胞核,并与NONO/p54nrb蛋白结合,组装成核内旁斑。为了进一步阐明作用机制,作者通过DRIP-qPCR实验发现circTACC3在脂质过载条件下形成R-loop,并通过DRIP-ChIRP测序与CUT&Tag联合分析发现circTACC3与 DNA断裂位点(DSB)结合,形成DSB-circTACC3-R-loop。Hi-C与RT-qPCR实验表明这些R-loop进一步促进拓扑关联域(TAD)的接触和融合,并选择性激活与MASH相关肝细胞癌恶性表型相关的基因。此外,通过诱导表达RNase H1(R-loop降解酶)和m6A修饰干预,作者还发现circTACC3-R-loop对circTACC3核斑点的组装和聚集具有正反馈调控作用,进一步增强其在DSB位点的聚集。
技术路线

结果展示
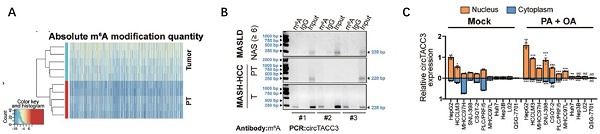
图1:m6A修饰的circTACC3在MASH相关HCC中高表达。
A. Arraystar m6A circRNA表观芯片聚类热图显示MASH相关HCC患者组织与邻近正常组织的m6A circRNA表达差异;
B. meRIP-PCR验证携带m6A修饰的circTACC3在MASH相关HCC组织高表达;
C. 核质分离与RT-qPCR显示circTACC3主要定位于细胞核。
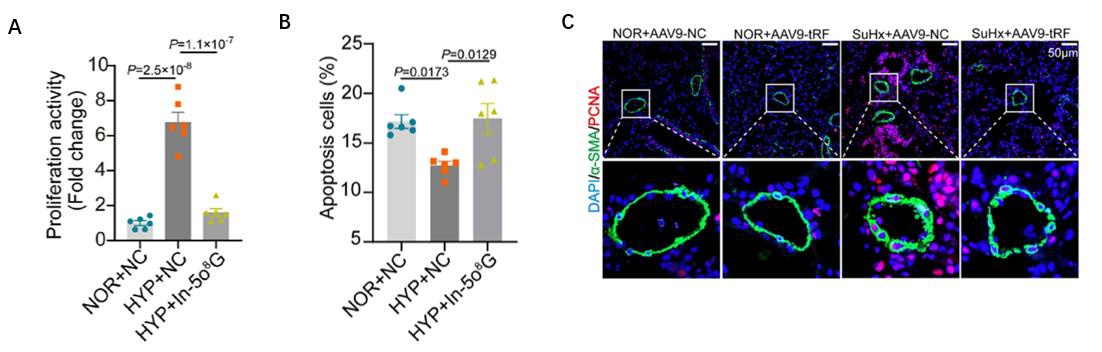
图2:功能研究,m6A修饰的circTACC3促进MASH相关HCC进展。
A. 在脂质过载条件, circTACC3高表达的MASH相关HCC形成的类器官体积更大,存活能力更强;
B. 敲除circTACC3显著增加了MASH相关HCC在脂质过载条件下的凋亡水平;
C. m6A修饰抑制剂(STM2457、SAH和DAA)显著抑制了脂质过载诱导的类器官体积变大。
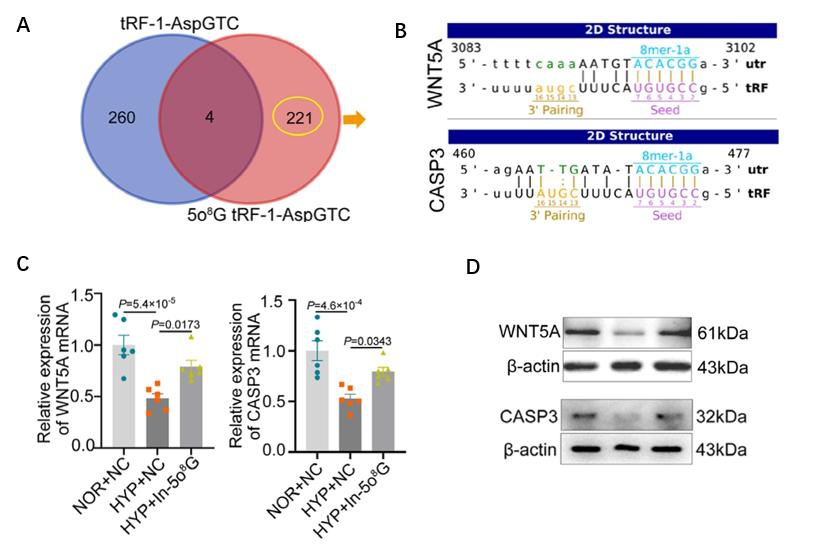
图3:机制研究1,m6A促进circTACC3定位于细胞核,并与NONO/p54nrb蛋白相互作用。
A. meRIP-PCR实验显示m6A修饰的circTACC3主要定位于细胞核;
B. m6A抑制剂降低了circTACC3在细胞核的比例;
C. RIP-qPCR实验显示NONO/p54nrb与circTACC3结合;
D. 敲除NONO/p54nrb降低了circTACC3在细胞核的比例;
E. m6A抑制剂显著干扰了NONO/p54nrb与circTACC3结合。
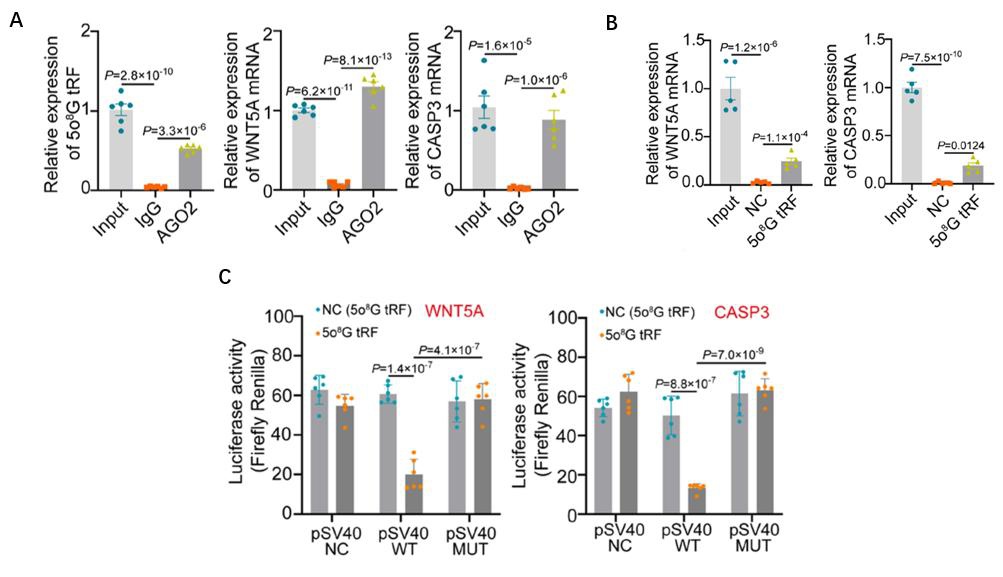
图4:机制研究2,circTACC3与 DNA断裂位点(DSB)结合形成R-loop,促进TAD的接触和融合,并选择性激活与MASH相关肝细胞癌恶性表型相关的基因。
A. DRIP-qPCR实验显示m6A修饰的circTACC3在细胞核形成R-loop;
B. DRIP-ChIRP测序显示与脂质过载诱导呈正相关或与m6A修饰干预呈负相关的circTACC3 R-loop的基因分布情况;
C. DRIP-ChIRP测序、γH2AX CUT&Tag和Hi-C联合分析显示脂质过载诱导的DSB-circTACC3 R-loop促进染色质TAD结构接触;
D. 脂质过载诱导的DSB-circTACC3 R-loop选择性激活与MASH相关HCC恶性表型相关的基因。
研究意义
本研究使用Arraystar circRNA表观芯片发现m6A修饰的circTACC3在MASH相关HCC组织中明显升高,并揭示了m6A修饰的circTACC3在在MASH相关HCC中的关键作用。在实验结果中,作者通过一系列实验表明m6A修饰的circTACC3响应代谢重编程(如脂质过载应激),驱动MASH相关HCC的恶性进展。机制上,m6A促进circTACC3的细胞核定位,并与NONO/p54nrb组装形成旁斑。这些旁斑被进一步招募到DNA损伤区域(DSB)形成R-loop结构。DSB-circTACC3-R-loop可以促进拓扑关联域(TAD)的接触和融合,并选择性激活与MASH相关HCC恶性表型相关的基因。该研究不仅有助于深入理解MASH相关HCC的病理机制,还为开发新的诊断标志物和治疗策略提供了重要的理论基础。
原文出处
https://onlinelibrary.wiley.com/doi/10.1002/cac2.70061
康成生物丨数谱生物可提供的相关技术服务

