

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
巨噬细胞在心肌梗死后从促炎的M1型向抗炎的M2型转变,是炎症消退和组织修复的关键。美国天普大学Raj Kishore团队采用Arraystar circRNA芯片筛选发现,环状RNA分子Cdr1as(circ-cdr1as)在促炎M1型巨噬细胞中显著下调,而在抗炎M2型巨噬细胞中显著上调。功能实验显示,注射circ-cdr1as过表达巨噬细胞或AAV9介导的circ-cdr1as过表达均显著改善心功能、减少梗死面积、增加血管密度;在分子机制方面,作者发现circ-cdr1as通过“海绵”作用吸附miR-7,解除其对KLF4的抑制,促进巨噬细胞向M2型极化。这些发现揭示了circ-cdr1as调控巨噬细胞极化,促进心肌梗死后心脏修复的机制,为开发基于circRNA的心脏修复策略提供了理论基础。
该研究成果于2025年发表在学术期刊Circulation Research上,影响因子为16.2。

研究背景
心血管疾病是全球主要死亡原因之一,心肌梗死后炎症反应在组织修复和心衰发展中起关键作用。巨噬细胞在心肌梗死后表现出动态极化:从促炎的M1型向抗炎的M2型转变,是炎症消退和组织修复的关键。环形RNA(circRNA)是一类稳定表达的非编码RNA,具有miRNA“海绵”功能,近年来在免疫调节和心血管疾病中被广泛关注。circ-cdr1as 是一种已知可靶向miR-7的circRNA,但其在心脏损伤后免疫调节中的作用尚不清楚。在之前的研究与这篇文章中,作者发现环状RNA cdr1as通过“海绵”作用吸附miR-7,调控巨噬细胞向M2型极化,促进心肌梗死后心脏修复,为环形RNA在心血管疾病中的免疫调节功能提供了新证据。
研究思路
作者着重于研究在心肌梗死后心脏修复时circ-cdr1as对巨噬细胞极化的调控作用。首先运用Arraystar circRNA芯片技术检测发现circ-cdr1as在促炎M1型巨噬细胞中显著下调,而在抗炎M2型巨噬细胞中显著上调,并对结果进行了qRT-PCR验证。作者进一步构建了小鼠心肌梗死手术模型,对不同时间点的circ-cdr1as水平进行了qRT-PCR检测,发现小鼠心肌梗死后3-5天,心脏中的circ-cdr1as显著下调,对应此时促炎M1型巨噬细胞占主导地位;小鼠心肌梗死后7-28天,心脏中的circ-cdr1as显著上调,对应此时抗炎M2型巨噬细胞占主导地位。此外,作者还对流式分选的不同细胞类型进行了circ-cdr1as的表达检测与验证。
在功能研究中,作者将circ-cdr1as过表达的巨噬细胞注射至小鼠心肌梗死区,发现circ-cdr1as过表达显著增加了M2型巨噬细胞比例,改善了心功能、减少了心肌细胞坏死和梗死面积、并增加了血管密度。作者还通过AAV9系统性递送circ-cdr1as至心肌细胞,显著增强了心脏中circ-cdr1as的表达水平,并改善了心脏功能,为开发基于circRNA的心脏修复提供了新的思路。
在机制研究中,作者发现在左心室组织、心肌细胞和巨噬细胞中,当circ-cdr1as显著下调时,miR-7表达水平显著增强;作者进一步利用circRNA pull-down实验验证circ-cdr1as与miR-7的结合;miR-7 mimic处理增加了促炎M1型巨噬细胞的比例,而miR-7 拮抗剂处理降低了促炎M1型巨噬细胞的比例。进一步的研究发现,miR-7 拮抗剂处理或circ-cdr1as过表达显著增强了miR-7靶基因KLF4的表达水平,过表达或敲除KLF4则会增强或抑制M2型巨噬细胞的比例。这些结果综合表明circ-cdr1as通过“海绵”作用抑制miR-7,解除其对KLF4的抑制,促进巨噬细胞向M2型极化。
技术路线

结果展示
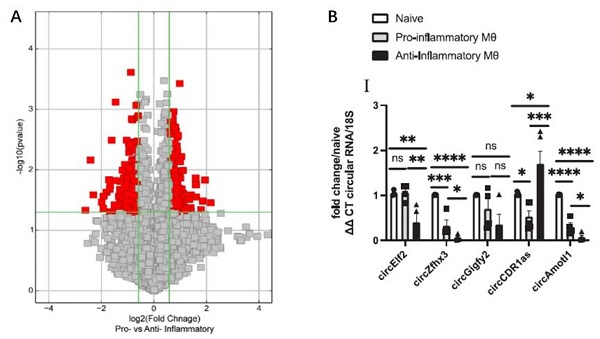
图1:circ-cdr1as在促炎M1型巨噬细胞中显著下调,而在抗炎M2型巨噬细胞中显著上调。
A.Arraystar circRNA芯片火山图显示促炎M1型巨噬细胞与抗炎M2型巨噬细胞的circRNA表达差异;
B. qRT-PCR验证circ-cdr1as在促炎M1型巨噬细胞中下调,而在抗炎M2型巨噬细胞中上调。
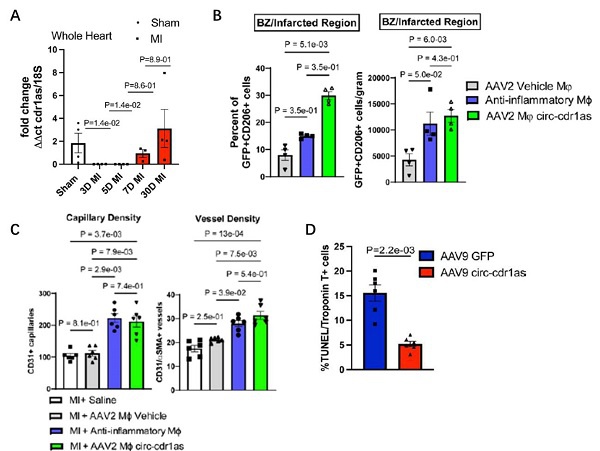
图2:功能研究,circ-cdr1as过表达改善心肌梗死后的心脏功能。
A: 小鼠心肌梗死后3-5天,心脏中的circ-cdr1as显著下调;心肌梗死后7-28天,心脏中的circ-cdr1as显著上调;
B: circ-cdr1as过表达显著增加了梗死区抗炎型M2巨噬细胞的比例;
C: circ-cdr1as过表达显著增加了毛细血管密度和血管密度。
D. circ-cdr1as过表达显著减少了心肌细胞的死亡。
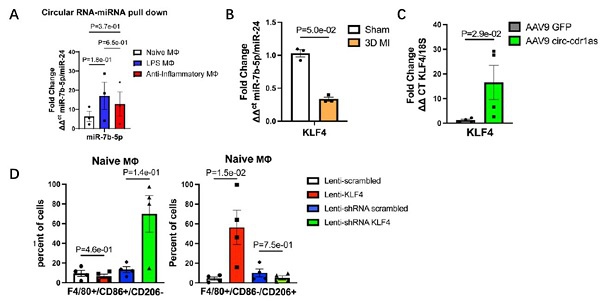
图3:机制研究,circ-cdr1as“海绵”吸附miR-7,解除其对KLF4的抑制,促进巨噬细胞向M2型极化。
A. circRNA Pull down实验证实circ-cdr1as结合miR-7;
B. miR-7 mimic抑制KLF4的表达;
C. circ-cdr1as过表达增强KLF4的表达;
D. 过表达KLF4显著降低了促炎M1型巨噬细胞的比例,提高了抗炎M2型巨噬细胞的比例;敲除KLF4显著提高了促炎M1型巨噬细胞的比例,降低了抗炎M2型巨噬细胞的比例。
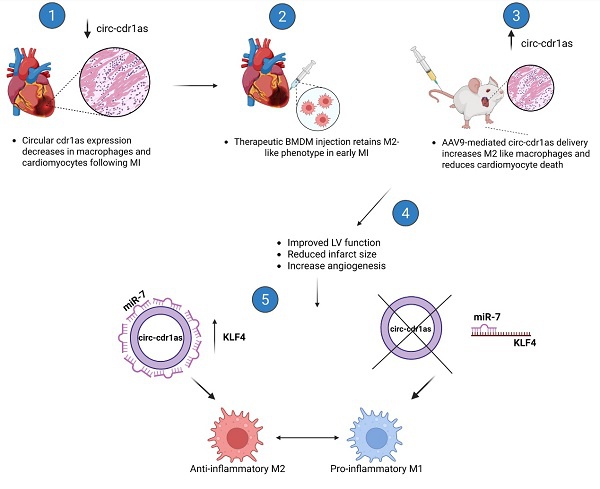
图4:功能与作用机制图。
circ-cdr1as在心肌梗死后3天显著下调,主要发生在巨噬细胞和心肌细胞中(1);注射的circ-cdr1as过表达巨噬细胞保持了M2型巨噬细胞形态(2);AAV9介导的circ-cdr1as过表达均显著增加了M2型巨噬细胞比例,降低了心肌细胞坏死(3);两种疗法均显著改善心功能、减少梗死面积、增加血管密度(4);circ-cdr1as通过“海绵”作用抑制miR-7,解除其对KLF4的抑制,促进巨噬细胞向M2型极化(5)。
研究意义
本研究使用Arraystar circRNA芯片分析了促炎M1型巨噬细胞和抗炎M2型巨噬细胞中环状RNA分子的表达差异,发现circ-cdr1as参与调控巨噬细胞促炎与抗炎类型的转变,首次揭示了circ-cdr1as在心肌梗死后巨噬细胞极化中的作用,并提出circ-cdr1as/miR-7/KLF4轴作为免疫调节新机制,促进心肌梗死后心脏修复。作者结合细胞治疗与基因治疗策略,验证circ-cdr1as的治疗潜力,为开发基于circRNA的心脏修复策略提供了基础。
原文出处
https://doi.org/10.1161/CIRCRESAHA.125.326377
https://doi.org/10.1016/j.lfs.2022.121003
注:作者将Arraystar circRNA芯片的结果先发表于文献2,将后续功能机制研究发表于文献1。
康成生物丨数谱生物可提供的相关技术服务

