

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
中山大学肿瘤防治中心云径平教授、陈春燕医生和汕头市中心医院王媛媛医生长期从事癌症放化疗研究,他们采用Arraystar snoRNA PCR芯片筛选发现,小核仁RNA分子SNORA58在食管鳞状细胞癌(ESCC)组织中显著上调。深入分析发现,SNORA58是预测新辅助放化疗(nCRT)反应的潜在生物标志物,高表达SNORA58的患者对nCRT达到完全缓解的可能性更低,临床结果也更差。功能上,SNORA58可增强癌细胞对放疗的耐受性,同时不影响其对化疗的敏感性。机制上,SNORA58通过抑制CTCF的泛素化降解来稳定其表达,进而导致JNK1下调并使JNK信号通路失活;这一过程会破坏细胞内铁稳态,从而减轻放疗诱导的铁死亡。使用JNK信号通路激活剂可显著恢复体外和体内高表达SNORA58的食管鳞癌细胞的放射敏感性。这些发现首次证实了SNORA58是食管鳞癌放疗耐受的关键调控因子,并揭示了在此特定背景下snoRNA与铁死亡之间的新关联,为食管鳞癌的治疗提供了潜在策略。 组蛋白合成过程中发挥着翻译检查点的作用,凸显了 TRMT6 以及tRNA修饰具有作为抗结直肠癌疗法潜在靶点的前景。
该研究成果于2025年发表在学术期刊Advanced Science上,影响因子为14.1(Arraystar snoRNA PCR芯片由康成生物|数谱生物提供技术服务)。

研究背景
食管鳞状细胞癌(ESCC)是食管癌的主要亚型,对放疗的敏感性存在显著差异。放疗耐受是ESCC治疗中的一个重大挑战,其分子机制尚未完全明确。小核仁RNA(snoRNA)在癌症中的作用逐渐被认识,但在ESCC放疗中的作用尚不清楚。这篇文章中,作者发现snoRNA分子SNORA58通过抑制JNK1介导的铁死亡,促进ESCC的放疗耐受,为snoRNA调控放疗耐受的机制提供了新的见解,为开发新ESCC的预测指标和治疗靶点提供了科学依据。
研究思路
文章着重于研究SNORA58 在ESCC的放疗耐受中的作用。作者运用Arraystar snoRNA PCR芯片检测发现SNORA58在低分化度的ESCC组织中显著上调,qRT-PCR和RNA原位杂交(RNA-ISH)进一步验证了SNORA58在ESCC组织中的高表达。K-M曲线分析发现高表达SNORA58与较差的预后和短生存期相关。作者还分析了多个临床中心的术前新辅助化疗放疗(nCRT)样本,发现高表达SNORA58的患者对放化疗反应差(pCR率低),确立SNORA58作为预测nCRT疗效的独立标志物。
在功能研究中,作者利用CRISPR-Cas9技术敲除高表达SNORA58的ESCC细胞系中的SNORA58,并利用慢病毒系统在低表达SNORA58的细胞系中过表达SNORA58,结果表明过表达SNORA58增强了ESCC细胞的放疗耐受能力,而敲除SNORA58则增加了ESCC细胞的放疗敏感性,SNORA58的表达改变不影响细胞对化疗药物的敏感性。作者进一步构建了SNORA58敲除和野生型KYSE510细胞的异种移植小鼠模型,评估了放疗对肿瘤生长的影响。结果表明SNORA58敲除组的肿瘤体积和重量显著减少,SNORA58敲除增强了小鼠肿瘤对放疗的敏感性。
在机制研究中,作者通过转录组测序分析SNORA58敲除细胞与野生型细胞在放疗后的基因表达差异,发现JNK1是受SNORA58调控的靶基因。作者使用JASPAR数据库分析发现,CTCF是SNORA58调控JNK1的潜在介导者。CHIP-qPCR证实CTCF蛋白与JNK1基因的启动子区结合,荧光素酶实验显示CTCF蛋白抑制JNK1基因的表达,RIP-qPCR实验证实SNORA58与CTCF蛋白直接结合。蛋白稳定性实验分析显示SNORA58显著抑制CTCF蛋白的泛素化水平,增强其稳定性。因此,SNORA58通过稳定CTCF蛋白,抑制JNK1的表达,从而抑制JNK信号通路的激活,增强放疗耐受能力。通过对放射诱导的细胞死亡抑制剂分析发现,铁死亡是受SNORA58调控的主要死亡类型。通过一系列细胞实验,包括脂质过氧化、PTGS2表达、线粒体形态变化等指标,作者发现SNORA58通过JNK1依赖的方式调节铁死亡,其敲除增加了铁死亡标志物的表达,而过表达则抑制了这些标志物。在SNORA58过表达的ESCC细胞异种移植小鼠模型中, JNK信号通路激活剂能够显著增强放疗的效果,减少肿瘤生长,且没有明显的毒性。
技术路线

结果展示
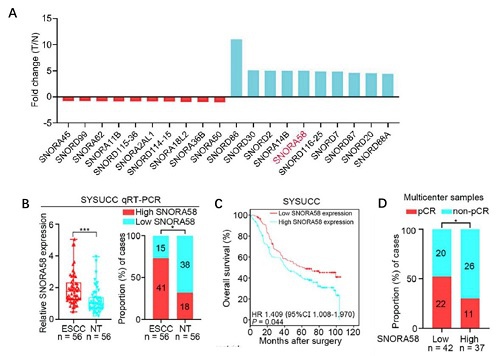
图1:SNORA58在ESCC患者肿瘤组织显著上调,并与不良预后有关,可作为预测nCRT疗效的独立标志物。
A. Arraystar snoRNA PCR芯片检测ESCC肿瘤组织与正常组织差异表达的snoRNA;
B. qRT-PCR验证SNORA58在ESCC肿瘤组织中显著高表达;
C. K-M生存曲线证明SNORA58的表达与ESCC患者的生存期显著相关;
D. 高表达SNORA58的患者对放化疗反应差(pCR率低),可作为独立标志物。
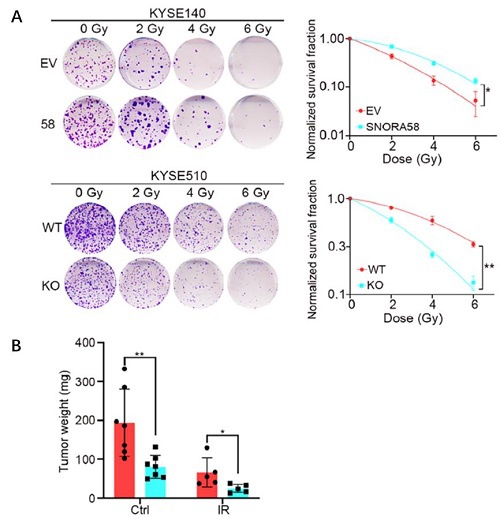
图2:功能研究,SNORA58促进ESCC的放疗耐受。
A. 过表达SNORA58增强了ESCC细胞的放疗耐受能力,而敲除SNORA58则增加了ESCC细胞的放疗敏感性;
B. 在异种移植小鼠模型中,敲除SNORA58显著促进了放疗的疗效;
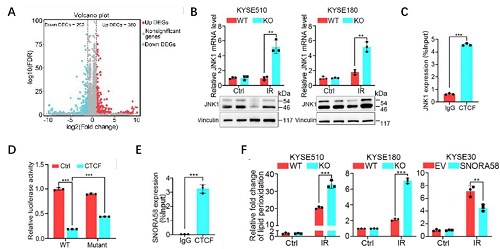
图 3:机制研究,SNORA58通过JNK1依赖的方式调节铁死亡。
A.转录组测序实验显示SNORA58敲除组与正常组在放疗后的基因表达差异;
B. qRT-PCR与western blot验证JNK1在SNORA58敲除组表达上调;
C. CHIP-qPCR验证CTCF蛋白与JNK1基因存在相互作用;
D. 双荧光素酶显示CTCF蛋白抑制JNK1的转录;
E. RIP-qPCR验证CTCF蛋白SNORA58相互结合;
F. 敲除SNORA58显著增强了放疗后的铁死亡标志物之一的脂质过氧化水平。
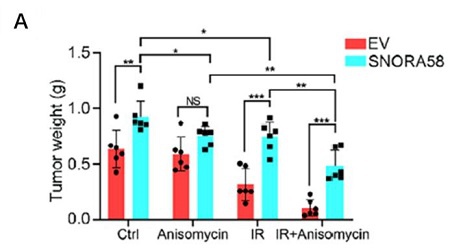
图 4:JNK信号通路激活剂Anisomycin显著增强放疗的效果。
A. Anisomycin处理显著减少了放疗后的肿瘤重量。
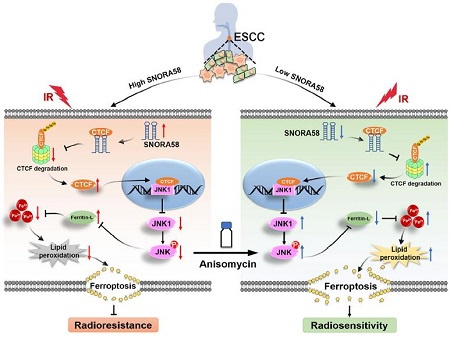
图 5:作用机制图。
在食管鳞癌(ESCC)患者中,SNORA58的表达水平存在异质性。该分子异常高表达时,通过抑制泛素介导的降解作用稳定CTCF蛋白,降低JNK1表达水平,进而破坏细胞内铁稳态,最终导致放射治疗诱导的JNK1介导的铁死亡过程减弱,这一系列分子机制共同促进了肿瘤的放射耐受。使用JNK信号通路激活剂anisomycin可有效逆转SNORA58诱导的放射耐受效应。
研究意义
本研究使用Arraystar snoRNA PCR芯片在低分化度的ESCC肿瘤组织中进行筛选,发现核仁小RNA分子SNORA58显著上调,大样本验证和临床统计结果显示SNORA58高表达可独立预测ESCC患者对新辅助放化疗(nCRT)的差疗效和短生存期,为临床筛选“放疗耐受”患者提供了可靠指标。在实验结果中,作者通过一系列实验表明SNORA58在食管鳞状细胞癌放疗耐受中的核心作用,阐明了一条全新的SNORA58-CTCF-JNK1-铁死亡调控轴,为理解放疗耐受的分子机制提供了新视角。最后,作者发现JNK通路激活剂(安尼霉素,anisomycin)可逆转SNORA58介导的放疗耐受,为克服临床放疗耐受提供了安全可行的联合治疗方案。总之,本研究首次将snoRNA、铁死亡和放疗耐受联系起来,不仅为ESCC的精准诊疗提供了新靶点和新策略,也为其他肿瘤的放疗增敏研究开辟了新的方向。
原文出处
https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202508515
RIP-qPCR

