

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
上海交通大学医学院附属仁济医院消陈萦晅、房静远团队发表了名为“TRMT6-mediated tRNA m1A modification acts as a translational checkpoint of histone synthesis and facilitates colorectal cancer”的研究性论文。该研究发现,转运RNA(tRNA)的N1-甲基腺苷(m1A)甲基转移酶 TRMT6 在人类结直肠癌(CRC)组织中表达上调,且与不良预后有关。该研究通过原位、转移性和条件性敲低小鼠模型,确定了TRMT6在CRC中的致癌作用。机制上,TRMT6通过维持TRMT6-TRMT61A复合物的稳定性来增加tRNA m1A水平。靶向抑制TRMT6介导的tRNA m1A修饰可以破坏tRNA-Lys-TTT-1-1的稳定性,并以密码子偏倚的方式损害组蛋白mRNA的翻译,从而限制组蛋白合成和细胞周期进程。因此,TRMT6 在结直肠癌细胞加速组蛋白合成过程中发挥着翻译检查点的作用,凸显了 TRMT6 以及tRNA修饰具有作为抗结直肠癌疗法潜在靶点的前景。
该研究成果于2025年6月发表在学术期刊Nature Cancer (IF: 28.5)上(康成|数谱生物提供了文章所采用的tRNA-seq技术服务)。

研究背景
结直肠癌(CRC)是全球第三大常见癌症,也是癌症相关死亡的第二大原因。尽管在手术、化疗、靶向治疗和免疫治疗方面取得了进展,但晚期CRC的预后仍然很差,生存率停滞不前。这对CRC分子机制的深入理解提出了迫切需求,以开辟早期检测、精确生物标志物和创新治疗的新途径。
tRNA修饰已成为翻译重编程的关键调控因子,已有证据显示m1A、m5C和m7G等修饰可以调控癌症细胞命运,影响肿瘤发生、恶性进展以及耐药性等,但其在结直肠癌(CRC)中的作用仍知之甚少。
研究思路
1. 筛选和鉴定CRC异常表达的关键tRNA修饰酶基因,并进行深入功能研究
研究者使用公共数据库中的RNA测序(RNA-seq)数据和蛋白质组学数据,分析了54个常见tRNA修饰酶的表达情况,筛选出在CRC中显著上调的tRNA m1A修饰酶基因TRMT6。他们通过RT-qPCR、WB、IHC以及组织芯片分析等一系列实验,证实了TRMT6在CRC组织中显著上调,生存曲线分析显示高TRMT6表达与患者的不良预后相关。
研究者在体外模型中探索了TRMT6的功能。他们通过siRNA技术敲低TRMT6,观察到CRC细胞的增殖和克隆形成能力显著下降,m1A水平降低。这些实验结果支持了TRMT6在CRC细胞增殖中的关键作用。为了进一步验证TRMT6的功能,研究者构建了多种体内模型,包括正交移植、转移和条件性敲低小鼠模型。他们发现敲低TRMT6抑制了异种移植肿瘤的生长,并且在条件性敲低小鼠中,TRMT6的缺失显著减少了诱导产生的肿瘤数量和负荷。
研究者进一步发现,TRMT6是通过维持TRMT6-TRMT61A复合体的稳定性来增加tRNA m1A水平,而且,TRMT6在CRC中的促癌作用是由其tRNA m1A修饰添加功能所介导。LC-MS tRNA修饰检测结果表明,敲低TRMT6导致了CRC中tRNA m1A修饰水平显著下降。
2. tRNA-seq和Ribo-seq高通量筛选揭示TRMT6作用机制
为了进一步揭示TRMT6在CRC中的作用机制,研究者进行了tRNA-seq实验,发现抑制TRMT6导致tRNA-Arg-ACG-1-1、tRNA-Tyr-GTA-8-1、 tRNA-Thr-AGT-4-1和tRNA-Lys-TTT-1-1的表达水平显著下降。Ribo-seq和RNA-seq分析结果显示,抑制TRMT6导致组蛋白mRNA的翻译效率下降。结合密码子偏好性分析,研究者发现组蛋白mRNA对密码子AAA和AAG有偏好性。因此,抑制TRMT6 介导的 tRNA m1A 修饰过程,破坏了 tRNA-Lys-TTT-1-1 等的稳定性使其水平下降,导致核糖体在tRNA-Lys-TTT-1-1 解码的AAA和AAG密码子处停滞,使得组蛋白mRNA的翻译效率下降。
组蛋白与DNA复制和细胞周期密切相关,TRMT6介导的tRNA m1A修饰水平上升,促进组蛋白mRNA翻译效率,以满足CRC细胞快速增殖的DNA复制需求。TRMT6的敲低导致新合成的组蛋白H2A、H2B、H3和H4水平显著下降,DNA复制受阻,CRC细胞停滞在G0/G1期,减少了进入S期的细胞比例。
为了进一步验证TRMT6-tRNA-组蛋白轴在CRC中的功能,研究者在TRMT6敲低的细胞中外源性过表达组蛋白或tRNA-Lys-TTT-1-1,均可挽救TRMT6敲低所导致的细胞活性降低。CRC组织中的tRNA-Lys-TTT-1-1表达水平高于其邻近正常组织,敲低TRMT6导致tRNA-Lys-TTT-1-1的降解速率上升等均证实了TRMT6-tRNA-组蛋白调控轴的存在。
3. 探索TRMT6作为CRC治疗药物靶点
研究者最后探索了TRMT6作为治疗靶点的潜力。他们设计了一种胆固醇结合的化学修饰siRNA(Chol-si-TRMT6),用于在体内靶向TRMT6。实验结果表明,Chol-si-TRMT6治疗显著抑制了异种移植肿瘤的生长,并且与CDK4/6抑制剂(palbociclib)联合使用时,效果更为显著。
技术路线

结果展示
1.tRNA m1A修饰酶TRMT6在CRC组织中表达上调,且与不良预后有关。
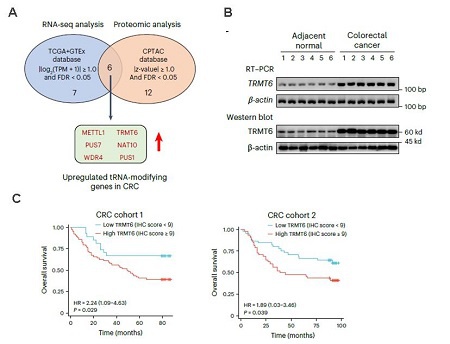
图1. A. 利用转录组学和蛋白组学分析发现,CRC组织上调的tRNA修饰酶基因;B. RT-PCR与WB实验验证tRNA m1A修饰酶TRMT6在CRC组织中上调;C.生存曲线分析显示TRMT6高表达与不良预后有关。
2.功能研究:TRMT6促进CRC进展,该过程由tRNA m1A所介导。
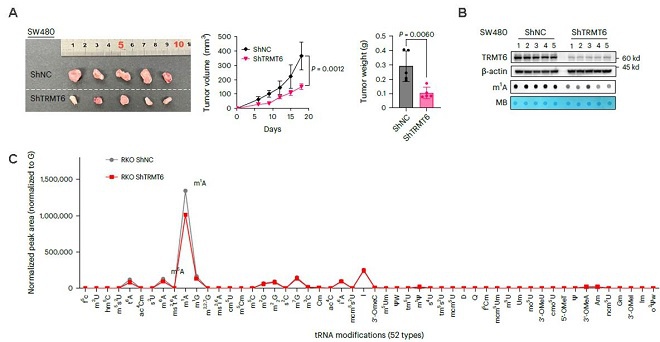
图2. A. 敲低TRMT6显著抑制了异种移植肿瘤的生长;B. Dot Blot 实验发现tRNA m1A修饰在敲低TRMT6后水平显著下降;C. LC-MS实验表明tRNA m1A修饰在敲低TRMT6后水平显著下降。
3.机制研究:tRNA-seq和Ribo-seq等实验表明,TRMT6介导的m1A修饰调控tRNA-Lys-TTT-1-1的稳定性,以密码子偏倚的方式影响组蛋白的翻译过程,从而调控组蛋白合成和细胞周期进程。
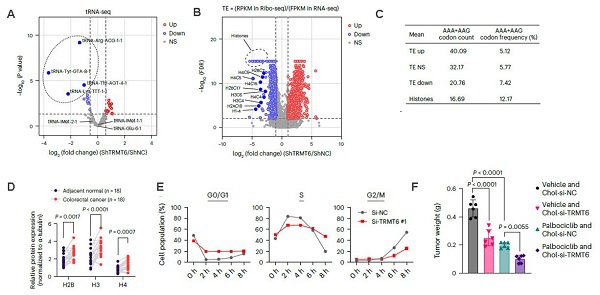
图 3. A. tRNA-Seq检测发现敲低TRMT6后tRNA-Lys-TTT-1-1等tRNA水平下降;B. Ribo-Seq与RNA-Seq联合分析发现,敲低TRMT6显著抑制了组蛋白mRNA的翻译效率;C. 组蛋白对tRNA-Lys-TTT-1-1解码的密码子存在明显偏好;D. CRC组织中的新和成组蛋白水平显著高于邻近健康组织;E. 敲低TRMT6 使得CRC细胞停滞在G0/G1期,减少了进入S期和G2/M的细胞比例; F. Chol-si-TRMT6治疗显著抑制了异种移植肿瘤的生长,并且与CDK4/6抑制剂(palbociclib)联合使用时,效果更为显著。
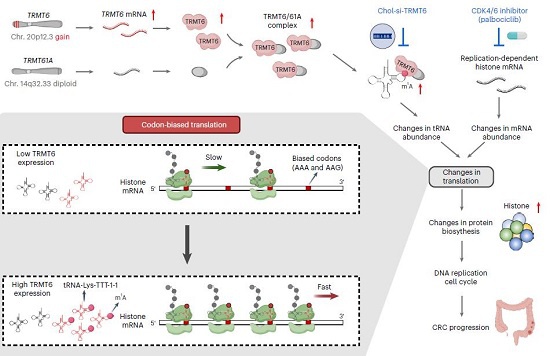
图 4.TRMT6 介导的 tRNA m1A 修饰在调控 CRC 进展中的作用和内在机制。拷贝数增多介导的TRMT6过表达导致TRMT6-TRMT61A复合物蛋白水平升高,使得CRC中tRNA m1A修饰水平升高。这种修饰特异性地稳定了 tRNA-Lys-TTT-1-1,增强了对组蛋白mRNA 偏好的AAA/AAG 密码子的解码效率,从而增强组蛋白 mRNA 的翻译水平。TRMT6 过表达会加速组蛋白的生物合成,支持 DNA 复制和细胞周期进展,最终促进 CRC 的发展。通过 Chol-si-TRMT6 或/和 palbociclib 限制组蛋白的生物合成对 CRC 有着良好的治疗效果。
研究意义
该研究首次揭示了tRNA N1-甲基腺苷(m1A)修饰酶TRMT6通过稳定tRNA-Lys-TTT-1-1,特异性促进组蛋白mRNA的密码子偏倚翻译,形成“TRMT6-tRNA-组蛋白”致癌轴,成为CRC细胞组蛋白合成的关键“翻译检查点”。临床数据表明TRMT6高表达与患者不良预后显著相关,而靶向TRMT6的胆固醇修饰siRNA(Chol-si-TRMT6)在动物模型中显著抑制肿瘤生长与转移;联合CDK4/6抑制剂可进一步增强疗效。该研究不仅拓展了tRNA修饰在癌症中的机制认知,还为CRC提供了新的预后标志物与精准治疗靶点,具有很强的临床转化潜力。
文章原文
https://www.nature.com/articles/s43018-025-00977-4
康成生物丨数谱生物可提供的相关技术服务
tRNA-seq
Ribo-seq
tRNA修饰测序-m1A/m3C/m1G/m2,2G
Arraystar Human tRNA Modification Enzymes PCR芯片
RT-qPCR

