

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
近日,比利时列日大学 GIGA 研究所癌症信号实验室的首席研究员Pierre Close及研究团队在国际著名学术期刊Nature cell biology(IF=21.3)杂志发表了题为“Valine aminoacyl-tRNA synthetase promotes therapy resistance in melanoma”的研究文章。
tRNA的动态表达以密码子特异性的方式调控mRNA的翻译,影响癌症发展。特定的氨酰-tRNA合成酶可以促进或抑制肿瘤发生。在黑色素瘤中,对MAPK靶向治疗产生的耐药引起了密码子偏倚的翻译重编程,文章结果显示缬氨酰-tRNA合成酶(VARS)在该过程发挥关键作用。作者利用Arraystar rtStar™ PCR 系列试剂研究发现,对缬氨酸的使用偏好、相应的缬氨酸cognate tRNA及VARS表达的上调导致患者来源的MAPK治疗耐药黑色素瘤中发生蛋白质组的重构。In vivo和in vitro功能研究发现,VARS敲低使得对MAPK治疗耐药的黑色素瘤对MAPK治疗重新敏感化。机制研究发现,VARS调节了富含缬氨酸的转录本的mRNA翻译,其中羟丙酰CoA脱氢酶mRNA编码了脂肪酸氧化中的关键酶。抗药性黑色素瘤培养依赖脂肪酸氧化和羟丙酰CoA脱氢酶来在MAPK处理中维持其生存。总之,文章数据表明VARS可能是治疗耐药黑色素瘤的潜在靶点。(康成|数谱生物提供采用Arraystar 试剂和技术的tRNA测序和tRNA PCR服务)。

研究背景
患有BRAFV600E型黑色素瘤的患者约占人类黑色素瘤的50%,携带着常规的MAPK信号激活,并且符合接受MAPK靶向治疗的条件。尽管治疗反应率高达70%,但由于获得性药物耐药性的产生,患者在经过数月的治疗后会出现疾病进展。除了基因突变外,非遗传适应机制在治疗耐药性中起到了一定作用,例如tRNA修饰、表达及氨酰-tRNA合成酶(aaRSs)的变化。
tRNA分子和氨酰-tRNA合成酶(aaRSs)在各种疾病,尤其是癌症的形成、进展和转移中起着重要作用。tRNA氨酰转移酶将氨基酸加载到相应的tRNA上,确保蛋白质合成的准确性。最近的研究揭示了aaRS在癌症中可作为潜在的治疗靶点:在胰腺肿瘤细胞中敲低苏氨酸氨基酰-tRNA合成酶可以抑制致癌蛋白mucin-1(富含苏氨酸)的表达,有利于癌细胞的迁移;脯氨酸tRNA氨酰转移酶的抑制剂能够通过阻断胶原蛋白(富含脯氨酸)的生物合成、预防细胞纤维化。
这篇文章阐明了在BRAFV600E黑色素瘤对MAPK治疗产生耐药性时发生的翻译重编程过程,揭示了驱动药物耐药的关键机制。作者结合定量蛋白质组学、Ribo-seq、tRNA测序和qPCR验证,证明了缬氨酸氨酰-tRNA合成酶(VARS)通过调节tRNA表达水平调控特定mRNA翻译,最终影响肿瘤细胞耐药性的产生。
实验思路

实验方法
1.高通量筛选:耐药黑色素瘤蛋白质组和tRNA测序分析
在与MAPK治疗耐药(RES)患者vs对照组(SENS)黑色素瘤中进行定量蛋白质组学分析(图1A)。GSEA分析证实胆固醇稳态、上皮-间质转换和脂肪酸(FA)代谢途径在RES组中呈上调趋势。在耐药组中,缬氨酸、丙氨酸和酪氨酸在上调蛋白质中显著富集,且天冬氨酸、缬氨酸、丙氨酸、异亮氨酸密码子在上调蛋白质对应的转录本中都显著富集。以此推测,携带特定氨基酸的tRNA表达变化会与蛋白质组变化相呼应,支持肿瘤的进展和转移。文章对SENS和RES黑色素瘤肿瘤细胞进行了tRNA测序,观察到tRNA表达水平存在显著差异(图1B)。其中,tRNA-Val-CAC isoacceptor显著上调,并与编码RES培养中上调蛋白质的转录本中特异富集的GTG密码子相关。通过tRNA RT-qPCR验证了患者黑色素瘤样本中tRNA-Val-CAC的上调(图1C)。总的来说,这些发现突显了缬氨酸及携带它的tRNA在耐药黑色素瘤中的重要性。
文章进而对蛋白组学中tRNA氨酰转移酶进行分析,发现RES组VARS(缬氨酸tRNA氨酰转移酶)的表达水平显著上调,这与tRNA-Val的增加以及在RES培养物中上调蛋白质中缬氨酸的富集一致。在与其SENS对应物相比,RES M395、MM029和MM099黑色素瘤培养物中的VARS蛋白表达增强,并且与VARS氨酰化活性的增加相关。TCGA数据库中,相比于正常黑色素细胞,VARS在肿瘤中显著上调。高VARS表达与黑色素瘤患者的较低总体生存率相关联(图1D)。
2.功能研究:VARS影响黑色素瘤细胞对MAPK疗法的抵抗
In vitro功能实验发现,敲低VARS使多种RES黑色素瘤细胞对BRAF抑制剂呈显著的剂量依赖性再敏感化(图2A)。In vivo功能实验发现,VARS敲低的RES A375细胞植入NOD-SCID小鼠,并注射维姆拉非尼显著抑制肿瘤的生长(图2B)。因此,VARS的消耗与MAPK疗法协同作用,在体外限制黑色素瘤的存活,并在体内治疗时限制抗药性黑色素瘤的生长。
3.机制研究:VARS调控富含缬氨酸的mRNA翻译进而调控FA氧化
为了评估在RES M395细胞中敲低VARS是否会影响特定mRNA的翻译,文章进行了Ribo-seq,并根据它们在缬氨酸密码子中的丰富程度对转录本进行了进一步分类(前25%和后25%),发现VARS敲低导致富含缬氨酸转录本的核糖体占据显著且特异地减少(图3AB)。
将VARS敲低前后的蛋白质组学与转录组学数据整合(图3C),发现VARS翻译的特征指标(蛋白下调, mRNA不变且富含缬氨酸)在MAPK治疗抵抗相关的FA代谢和mTORC1信号传导等多条通路富集(图4A);其中羟丙酰CoA脱氢酶(HADH)与脂肪生成、FA代谢相关,可作为后续黑色素瘤抵抗的VARS靶点(图4BC)。在RES M395培养物中敲低VARS或HADH,可以降低FA氧化活性(图4D),使RES M395重新对BRAFi敏感,表明VARS通过调节HADH mRNA翻译在抵抗性黑色素瘤培养物中调节FA氧化。
结果展示
1. 高通量筛选:耐药黑色素瘤蛋白质组和tRNA测序分析
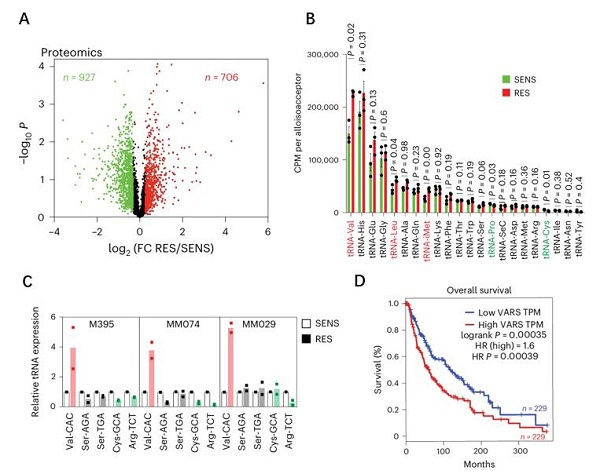
图1. A.火山图显示对vemurafenib敏感或耐药的黑色素瘤M395细胞的蛋白组学差异指标;B. 柱形图显示黑色素瘤M395敏感或耐药的细胞中tRNA测序差异tRNA isoacceptors;C. qPCR验证显示tRNA-Val-CAC在多种黑色素瘤耐药细胞中上调;D. KM生存分析显示VARS高表达与黑色素瘤患者的较差预后相关联
2. 功能研究VARS影响黑色素瘤细胞对MAPK疗法的抵抗
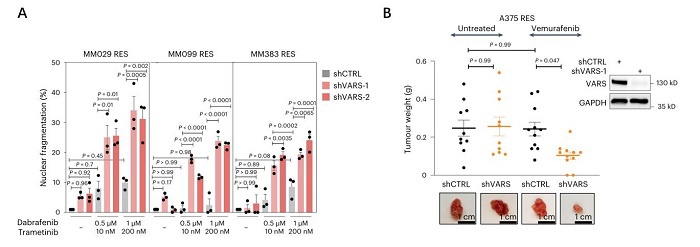
图2. A. In vitro实验表明,BRAF/MEK抑制剂抵抗的黑色素瘤患者来源的肿瘤细胞中敲低VARS使得其对抑制剂治疗呈显著的剂量依赖性再敏感化;B. 将VARS敲低的RES A375细胞植入NOD-SCID小鼠,并注射BRAF抑制剂可显著抑制黑色素瘤的生长。
3. 机制实验证明VARS调控富含缬氨酸的mRNA翻译
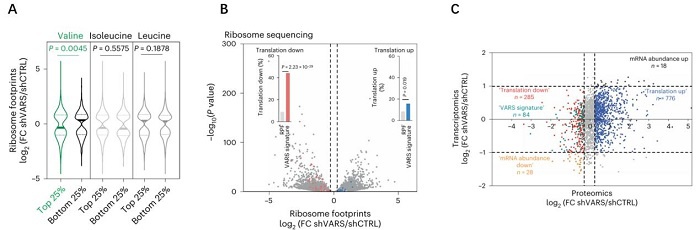
图3. A. 小提琴图显示ribo-seq中,敲低VARS前后富含缬氨酸转录本的核糖体占据显著减少; B. 火山图显示Ribo-seq中,敲低VARS前后VARS翻译的特征指标核糖体占据显著下调;C. VARS敲低前后的蛋白质组学与转录组学四象限图显示VARS翻译的特征指标蛋白水平显著下调。
4. 机制实验证明VARS调控HADH的mRNA翻译进而影响FA氧化
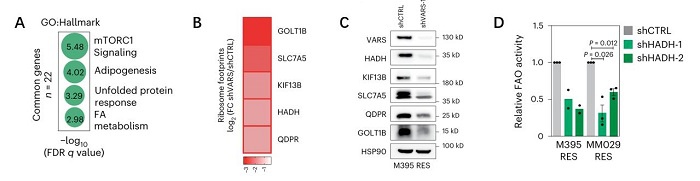
图4. A. GO富集分析显示富含缬氨酸的VARS翻译特征基因富集于mTOR、脂肪生成、FA代谢等条目;B.C. Ribo-seq和WB显示VARS影响的翻译特征基因中包含HADH;D.氧化活性测定实验显示耐药黑色素瘤细胞中HADH敲除抑制FA氧化。
研究意义
本研究通过蛋白组学和tRNA测序研究耐药黑色素瘤,发现缬氨酸在上调蛋白富集且tRNA-Val-CAC上调,通过Arraystar rtStar™ PCR 系列试剂对tRNA表达水平进行了验证,相应的参与FA代谢、且富含缬氨酸的蛋白也有普遍上调,生存分析提示VARS蛋白在耐药RES组上调且其高表达与黑色素瘤不良预后相关。tRNA-Val-CAC和VARS的上调促进缬氨酸富集的FA代谢相关转录本翻译水平提高,其中包括羟丙酰CoA脱氢酶HADH,而HADH上调促进了FA氧化活性,最终促进黑色素瘤MAPK抑制剂耐药。总的来说,文章详细研究了VARS作为黑色素瘤靶向治疗抵抗的推动因素,并为RES黑色素瘤患者提供了具有吸引力的治疗机会。
原文出处
https://www.nature.com/articles/s41556-024-01439-2
康成生物丨数谱生物可提供的相关技术服务

