

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
中山大学孙逸仙纪念医院姚婷婷教授长期从事宫颈癌相关研究。课题组采用Arraystar circRNA芯片筛选发现环状RNA分子CDR1as在TGF-β诱导的宫颈癌细胞中显著上调。实验结果显示,CDR1as过表达显著促进肿瘤细胞迁移和侵袭、促进肿瘤组织生长,大样本验证显示CDR1as能够作为生物标志物预测宫颈癌转移患者预后情况;在分子机制方面,作者发现CDR1as通过结合IGF2BP1蛋白增加转录因子Slug的mRNA稳定性和表达水平,从而促进宫颈癌的转移。这些发现表明,TGF-β信号传导可能通过CDR1as促进宫颈癌转移,为宫颈癌治疗提供了潜在的靶点。
该研究成果于2023年发表在学术期刊Molecular Cancer上,影响因子为41.444(Arraystar circRNA芯片由康成生物|数谱生物提供技术服务)。

研究背景
TGF-β是一种多功能细胞因子,与各种癌细胞的癌症转移有关,其中包括全球女性癌症发病率和死亡率极高的宫颈癌。尽管在其他多种肿瘤中TGF-β诱导的癌细胞转移得到了深入的研究,但在宫颈癌中涉及的机制尚不完全清楚。环状RNA是由pre-mRNA经过反向剪切形成的共价闭合单链RNA,对RNA外切酶不敏感,具有稳定性高的特点。已有研究表明,circRNA可以通过结合蛋白发挥各种调控功能。目前有越来越多的研究发现,circRNA在肿瘤的发生发展中扮演重要的角色。因此,本文重点关注了circRNA在TGF-β信号通路中的参与以及在宫颈癌转移过程中的作用机制,为开发相应治疗方案提供了可靠的机制研究基础。
研究思路
文章着重于研究TGF-β信号通路对宫颈癌在转移阶段CDR1as表达和活性的调控机制。作者运用Arraystar circRNA芯片技术检测发现在TGF-β过表达的宫颈癌细胞中CDR1as显著上调。进一步应用原位杂交检测其与淋巴结转移的相关性,结果表明CDR1as表达与淋巴结转移呈正相关并预示较差的生存期。在体内外实验中,作者证明了CDR1as的过表达能够促进宫颈癌的转移,并发现CDR1as能够增强IGF2BP1对SLUG mRNA调控的功能。同时,CDR1as通过激活TGF-β信号通路聚焦于下游的效应基因SLUG,促进EMT过程。以上结果表明CDR1as在宫颈癌转移中扮演了重要的角色。
功能研究发现,在肿瘤细胞转移侵袭实验以及划痕愈合实验中,过表达CDR1as可以促进Siha细胞的转移和侵袭、加速细胞划痕的愈合;在裸鼠体内进行皮下肿瘤注射模型实验发现,CDR1as过表达导致肿瘤体积增大;另外,作者还通过K-M曲线验证了CDR1as的高表达与宫颈癌淋巴结转移和预后不良有关,能够作为诊断和预测宫颈癌转移患者预后情况的生物标志物。
机制研究发现,过表达CDR1as引起SLUG基因mRNA和蛋白质表达水平上升。在这个过程中,作者利用RNA Pull down和RIP-PCR等实验发现CDR1as与m6A识别蛋白IGF2BP1结合。另外,在CDR1as过表达细胞中沉默IGF2BP1导致下游效应基因SLUG表达降低、细胞迁移能力减弱,进一步RIP-PCR实验证实IGF2BP1能够识别和结合下游效应基因SLUG的mRNA的m6A修饰位点,维持mRNA的稳定性。总之,这些结果表明在TGF-β诱导的宫颈癌迁移模型中,预后诊断标志物CDR1as的上调通过结合IGF2BP1蛋白来稳定SLUG基因的mRNA,促进宫颈癌的转移和恶化过程。
技术路线

结果展示
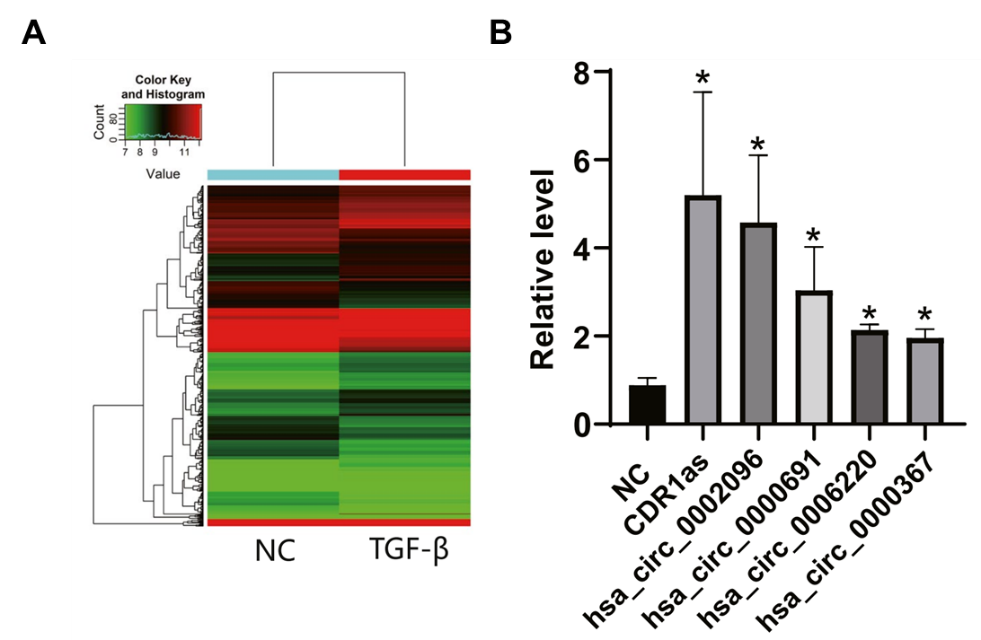
图1:CDR1as在TGF-β过表达的宫颈癌细胞显著上调。
A Arraystar circRNA芯片热图显示TGF-β过表达与对照组细胞的表达差异;
B qRT-PCR验证CDR1as是在过表达组与对照组中差异最显著的分子。
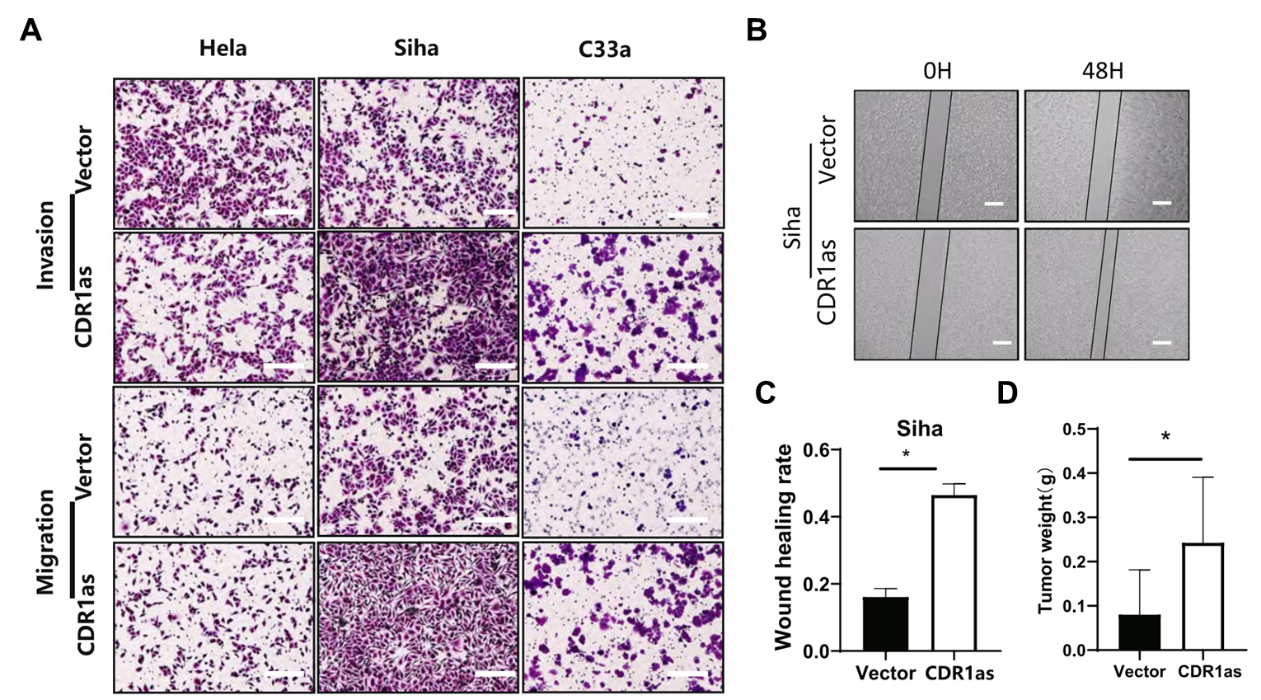
图2:功能研究1,验证CDR1as表达水平对细胞迁移的影响。
A 过表达CDR1as增强肿瘤细胞的迁移和侵袭能力;
B, C 划痕实验证明过表达CDR1as增强肿瘤细胞Siha的迁移能力;
D 裸鼠皮下肿瘤注射实验证明CDR1as过表达导致肿瘤体积增大。
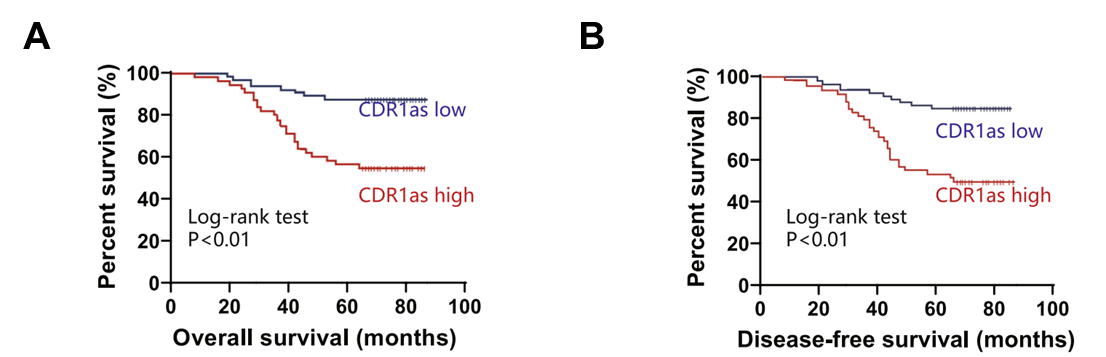
图3:功能研究2,K-M曲线显示CDR1as可作为宫颈癌转移和预后的生物标志物。
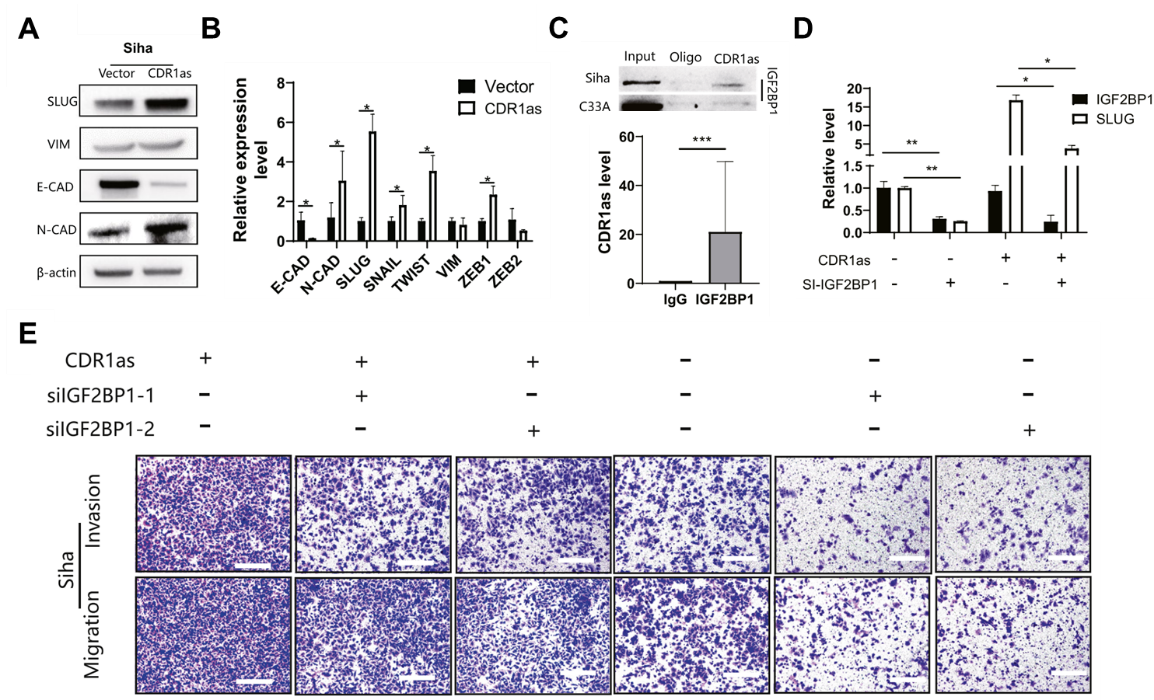
图4:机制研究1,CDR1as结合IGF2BP1蛋白并影响下游SLUG基因的表达水平。
A 过表达CDR1as引起SLUG基因蛋白质表达水平上升;
B 过表达CDR1as引起SLUG基因mRNA表达水平上升;
C RNA Pull down(上)和RIP-PCR(下)验证CDR1as与m6A识别蛋白 IGF2BP1结合;
D在CDR1as过表达细胞中沉默IGF2BP1导致下游效应基因SLUG表达降低;
E 在CDR1as过表达细胞中沉默IGF2BP1导致细胞迁移能力减弱。
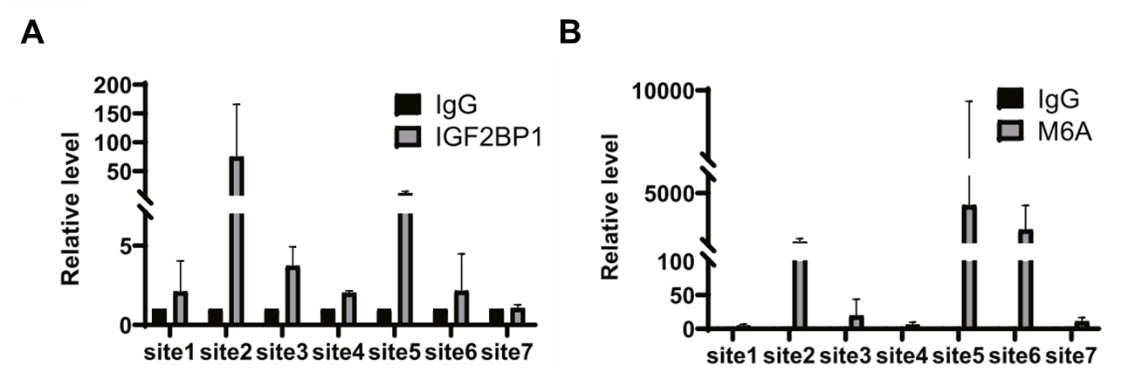
图5:机制研究2,IGF2BP1蛋白结合SLUG mRNA。
A IGF2BP1蛋白RIP-PCR验证IGF2BP1结合SLUG mRNA;
B MeRIP-PCR验证SLUG mRNA在IGF2BP1结合位点有m6A修饰。
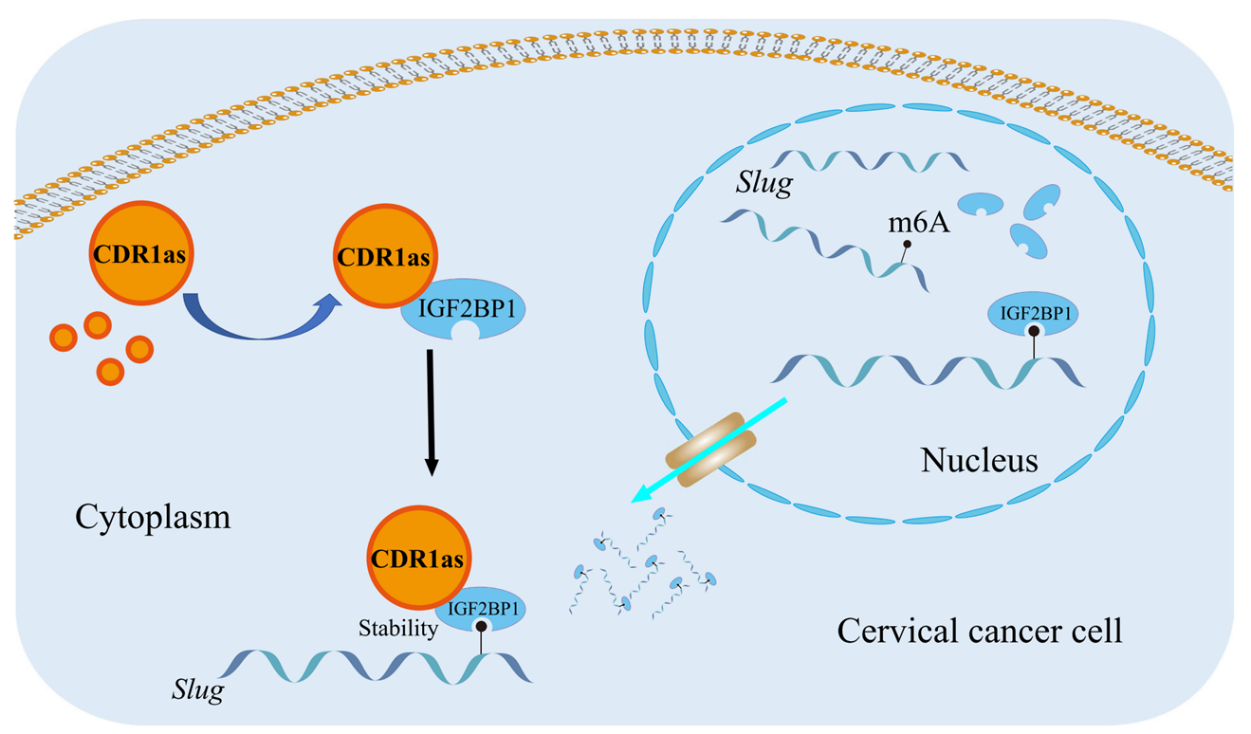
图6:作用机制图。
在以TGF-β高表达为标志的宫颈癌转移期,环状RNA分子CDR1as在肿瘤细胞中表达显著升高,并与m6A reader蛋白IGF2BP1结合,进一步介导其与下游基因SLUG的mRNA m6A修饰位点结合,增加mRNA的稳定性,使其避免被降解,使SLUG基因在mRNA和蛋白质水平表达显著上调。最终引起肿瘤细胞迁移和侵袭能力提高、肿瘤组织转移。
研究意义
本研究使用Arraystar circRNA芯片在TGF-β诱导的宫颈癌细胞中筛选,发现环状RNA分子CDR1as显著上调。可作为生物标志物预测宫颈癌转移患者预后情况,对宫颈癌转移的诊断和治疗具有良好的理论价值。在实验结果中,作者通过一系列实验表明CDR1as通过结合IGF2BP1蛋白和进一步结合SLUG mRNA的m6A修饰位点,增加该转录因子的mRNA稳定性,从而上调表达水平并最终促进宫颈癌的转移。这些发现深入研究了环状RNA分子CDR1as在TGF-β信号传导通路中的作用,并为宫颈癌治疗提供了潜在的靶点。
原文出处
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01743-9
康成生物丨数谱生物可提供的相关技术服务
RIP-PCR

