

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
中山大学肿瘤医院谢丹教授主要从事肿瘤侵袭转移机制和病理诊断及其分子标志物研究。该研究团队应用Arraystar lncRNA芯片筛选鉴定出由APC(adenomatous polyposis coli,腺瘤性结肠息肉基因) 通过PPARα激活的lncRNA-APC1。lncRNA-APC1通过与Rab5b mRNA的直接结合发挥其功能,降低其稳定性,并最终导致外泌体产生减少,进而抑制结直肠癌的发生发展。该研究成果于2019年发表在国际著名学术期刊Journal of Clinical Investigation.(IF:12.282)上。(芯片实验由康成生物丨数谱生物提供技术服务)

作者单位:中山大学肿瘤防治中心
研究背景
结直肠癌(CRC)是全世界癌症相关死亡的主要原因之一。已经充分确定CRC的发病机制遵循腺瘤-癌序列并且通过肿瘤抑制基因和癌基因异常的逐渐积累,涉及多步骤肿瘤发生。腺瘤性结肠息肉(APC)基因的突变在CRC的发生和发展中起关键作用。迄今为止,针对某些癌基因及其相关途径的方法是癌症治疗的最佳选择并能提高晚期患者的生存率。然而,因为APC是具有多种功能的大型支架蛋白,因此针对此靶点开发药物仍然具有挑战。
长链非编码RNA(lncRNA)是一大类长于200nt的转录物,没有蛋白质编码潜力。目前的研究表明,lncRNAs被精确调节,并且它们可以控制基因表达以调节生物学和/或病理过程的各个方面。已经显示lncRNA调节几种重要的癌症表型,包括增殖、凋亡、永生、运动和血管生成。因此,现在广泛认为lncRNA在挖掘癌症病理机制方面是非常有用的,并且提供其他预后价值或者甚至为癌症患者提供治疗选择。尽管如此,在CRC中参与调节APC的抗癌作用的某些lncRNA的功能以及它们可能具有的任何异常还有待阐明。
研究思路
为了研究APC基因在结直肠癌(CRC)的发病机制中起关键作用,作者通过Arraystar lncRNA芯片筛选鉴定了由APC激活的lncRNA(lncRNA-APC1),并在大量CRC组织中检测了这一lncRNA的表达。 lncRNA-APC1表达的减少与淋巴结和/或远处转移,更晚期的临床分期以及CRC患者的不良预后呈正相关。另外,APC可以通过抑制PPARα在lncRNA-APC1启动子上的富集来增强lncRNA-APC1的表达。lncRNA-APC1可以通过直接结合Rab5b mRNA并降低其稳定性来抑制外泌体的产生,从而抑制CRC细胞生长,转移和肿瘤血管生成。重要的是,源自lncRNA-APC1沉默的CRC细胞的外泌体通过激活内皮细胞中的MAPK途径促进血管生成。此外,外泌体Wnt1通过非经典Wnt信号传导大大增强了CRC细胞增殖和迁移。总的来说,lncRNA-APC1是由APC在CRC的发病机制中调节的关键lncRNA。我们的研究结果表明,APC调节的lncRNA-APC1程序是CRC患者可利用的治疗策略。
技术路线

结果展示
1、高通量筛选:过表达APC vs.con SW480/DLD-1细胞系通过Arraystar lncRNA array芯片高通量筛选,结果显示5个lncRNA在两种细胞里面有共同上下调趋势。qPCR验证及Biomarker研究发现lncRNA-APC1在结肠癌发生过程显著升高,低表达LncRNA-APC1预后生存期显著降低。
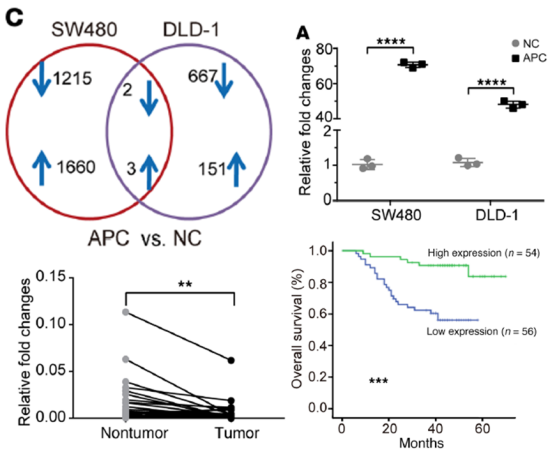
图 1. APC在SW480和DLD1中过表达后分别和对照比较之后的交集。qPCR检测APC的过表达结果。qPCR检测癌样本和非癌样本中lncRNA APC1的表达。KM生存曲线lncRNA-APC1和结直肠癌的生存期。
2、功能研究:过表达/敲低lncRNA-APC1影响肿瘤的增殖、侵袭、血管生成过程;
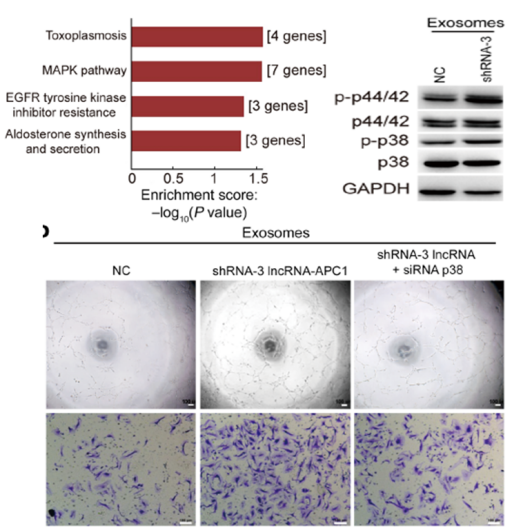
图2. 敲低lncRNA-APC1的RNA-seq结果显示MAPK,EGFR信号通路显著激活,WB结果证实RNA-seq的结果;敲低LncRNA-APC1的侵袭实验证实显著促进结直肠癌的转移。
3、机制研究 :FISH定位发现APC1-lncRNA主要定位在细胞质;Luciferase/CHIP实验:上游受PPARa调控,生信/MS2-RIP实验:下游结合Rab5b mRNA降低稳定性
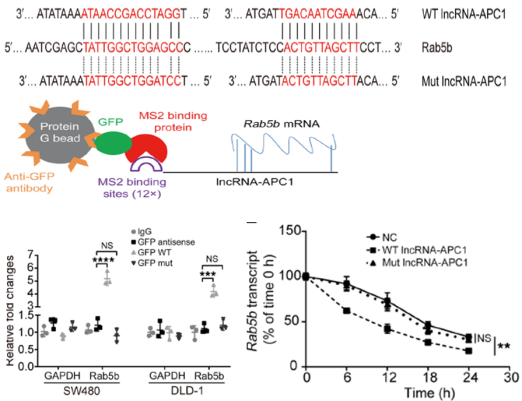
图3. 通过生信分析发现lncRNA-APC1与rab5b具有碱基互补序列。通过APC1野生型和突变型的MS2载体发现,LncRNA APC1可以和rab5b进行结合。
4、外泌体研究 APC1进入外泌体,改变癌细胞增殖、侵袭和血管生成,处理HUVECs可激活MAPK通路
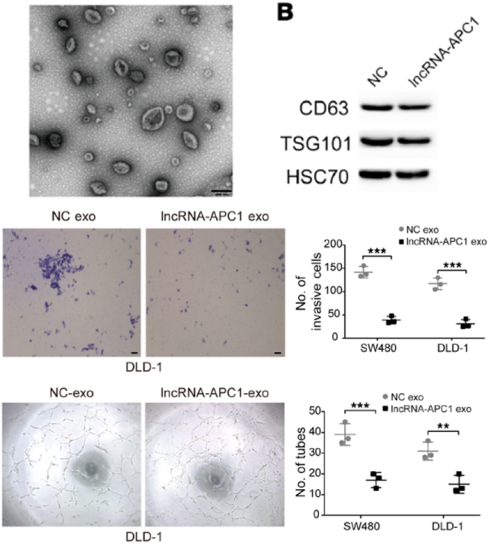
图4. 外泌体的电镜分析发现分离外泌体。WB实验结果证实CD63,TSG101,HSC70分离到的是外泌体。LncRNA-APC1发现lncRNA表达水平升高之后,可以显著抑制外泌体数目。
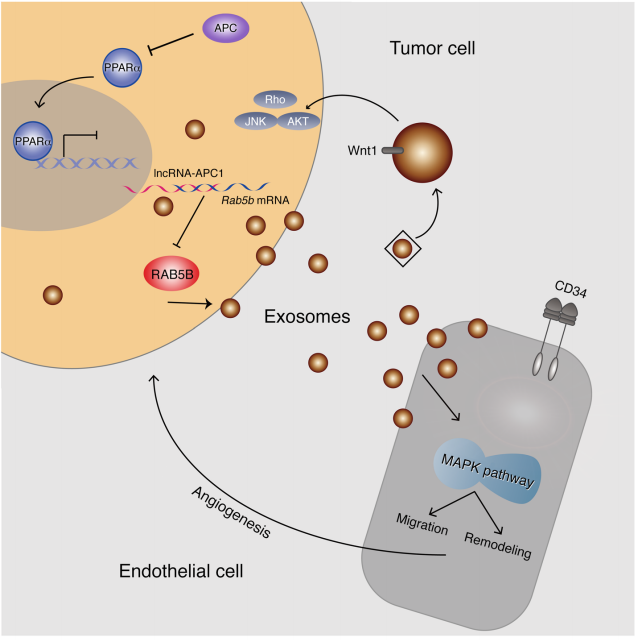
图5. lncRNA-APC1 在CRC病理进程中的功能和机制模式图:lncRNA-APC1作为APC的重要介导因子,通过直接降低Rab5b mRNA的稳定性和减少CRC细胞的外泌体产生抑制CRC的进展和/或其血管生成。
研究意义
本研究利用Arraystar Human LncRNA芯片筛选鉴定出由APC通过PPARα激活的lncRNA(TCONS_00027227),并命名为lncRNA-APC1。对大量CRC组织的检查和功能分析表明,lncRNA-APC1在CRC的发病机制中起着至关重要的肿瘤抑制作用。lncRNA-APC1表达的减少与淋巴结和/或远处转移、更晚期的临床分期以及CRC患者的不良预后呈正相关。进一步的机理研究表明,lncRNA-APC1通过Rab5b mRNA的直接结合发挥其功能,降低其稳定性,并最终导致外泌体产生减少。该作用抑制内皮细胞中MAPK途径的过度活化,并随后抑制血管生成。重要的是,该研究揭示了CRC衍生的外泌体Wnt1的致癌作用,其通过非经典Wnt信号传导以自分泌方式起作用。总的来说,研究数据揭示了CRC,APC/PPARα/lncRNA-APC1/Rab5b的致病过程中APC信号传导的机制,并揭示了人类CRC的几种预后和/或治疗靶标的潜力。
文章出处
相关技术服务

