

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
作者运用Arraystar Human LncRNA芯片检测了雄激素依赖性前列腺癌细胞(LNCaP)和雄激素非依赖性前列腺癌细胞(LNCaP-AI)中LncRNA的表达变化,发现PCAT1在LNCaP-AI细胞中显著上调。Western Blotting结果发现LncRNA-PCAT1能激活去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)中的AKT和NF-κB信号通路。RNA pull down ,RIP等实验表明LncRNA PCAT1与 FKBP51存在相互作用的关系,接下作者通过一系列实验证实LncRNA-PCAT1以PCAT1-FKPB51-IKKα复合体的形式发挥作用,并激活CRPC中的AKT和NF-κB信号通路。最后作者通过体外细胞GOF和LOF功能实验以及体内实验,证实了敲降LncRNA-PCAT1可以抑制去CRPC的生长。作者的研究为CRPC的潜在生物标志物以及潜在治疗靶点提供了有价值的研究思路。该研究发表在Nucleic Acids Research(IF=11.56)上。(芯片实验由康成生物提供技术服务)
研究背景:
前列腺癌是男性最常见的恶性肿瘤,在西方国家仍然是男性癌症相关死亡的第二大原因。大多数最初对雄激素剥夺疗法敏感的患者逐渐会对治疗产生抵抗,并且发展为去势抵抗性前列腺癌*。转移性去势抵抗性前列腺癌是一种恶性疾病,虽然目前有多种系统治疗法对其进行治疗,但仍然收益甚微,因此亟需探索去势抵抗性前列腺癌治疗的新机制。
文献报道指出LncRNA-PCAT1在多种癌症中的作用,并发现PCAT1可以促进细胞增殖,然而关于PCAT1在去势治疗相关环境中的作用并未有相关研究,本文作者围绕LncRNA在去势抵抗性前列腺癌进展中的作用进行了探索。

技术路线:
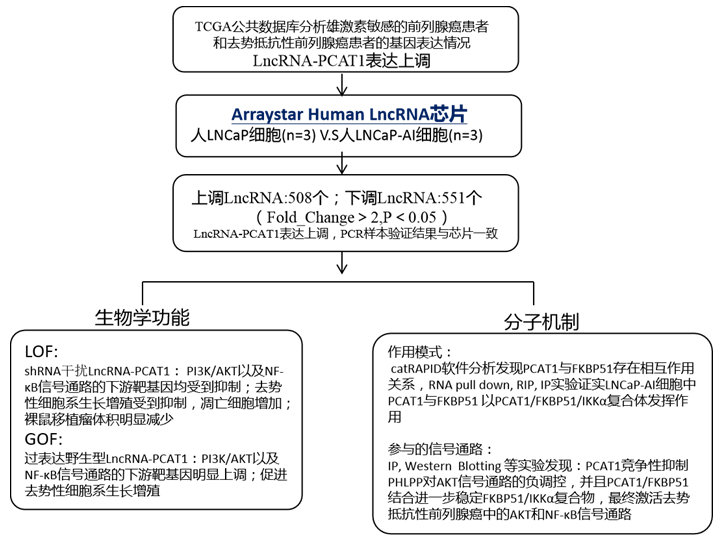
研究结果:
LncRNA-PCAT1表达与前列腺癌进展和趋势抵抗的发展密切相关
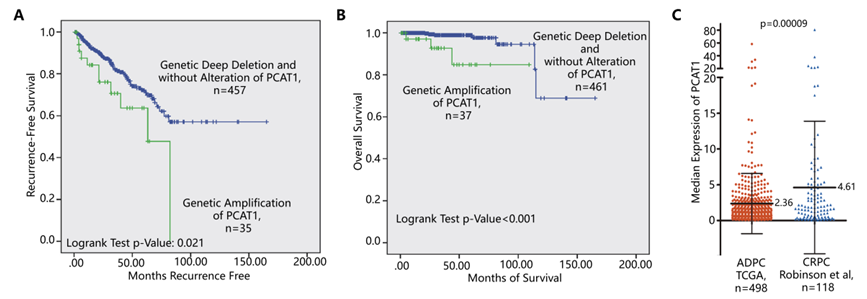
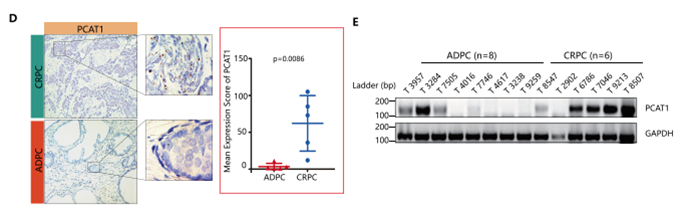
作者通过检索和分析已发表文献及公共数据库发现lncRNA PCAT1基因表达上调的前列腺癌患者与其他PCAT1基因表达正常或降低的患者相比,其无复发生存率以及总生存率均更差;并且与雄激素敏感的前列腺癌患者相比,去势抵抗性前列腺癌患者中PCAT1表达更高(下图A,B,C)。之后5组雄激素敏感的前列腺癌患者和去势抵抗性前列腺癌患者的RNA原位杂交实验以及RT-PCR实验结果均证实了这一结论(下图D,E)。
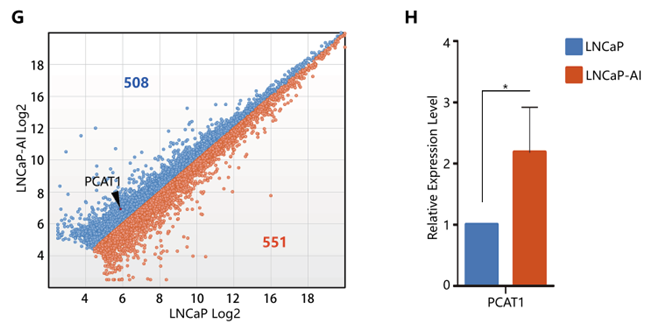
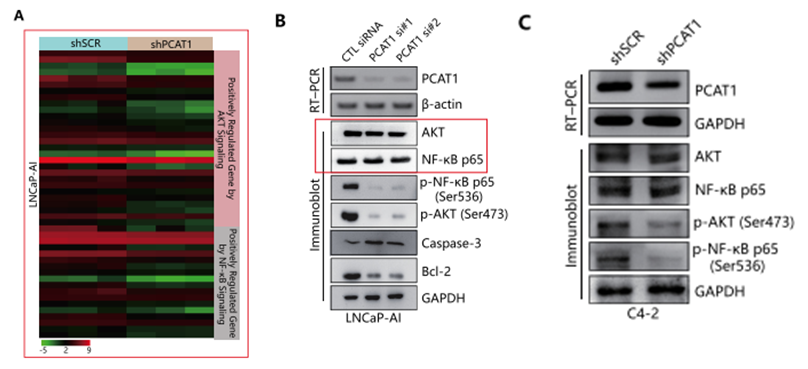
作者随后使用Arraystar Human LncRNA芯片检测了雄激素依赖性前列腺癌细胞LNCaP(n=3)和雄激素非依赖性前列腺癌细胞LNCaP-AI(n=3)中LncRNA的表达变化,发现508个上调的LncRNA和551个下调的LncRNA(FC>2,P<0.05),其中,PCAT1在LNCaP-AI细胞中显著上调(FC>2),PCR验证与芯片结果一致(下图G,H)。
LncRNA-PCAT1激活去势抵抗性前列腺癌中的AKT和NF-κB信号通路
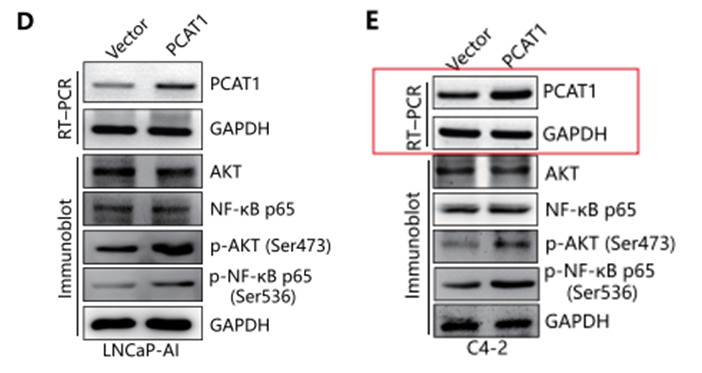
作者检测正常LNCaP-AI细胞和LncRNA-PCAT1敲降的LNCaP-AI细胞中mRNA的表达谱变化,发现在LncRNA-PCAT1敲降的LNCaP-AI细胞中,PI3K/AKT以及NF-κB信号通路的下游靶基因均受到抑制(下图A)。同时,PCAT1敲降的LNCaP-AI细胞以及C4-2细胞(PCAT1稳定低表达)中的Western Blotting结果进一步验证了这一结论(下图B,C)。而在LNCaP-AI和C4-2细胞中过表达PCAT1,则出现相反的结果(下图D,E)。
LncRNA PCAT1与介导AKT和NF-κB信号通路的FKBP51相互作用
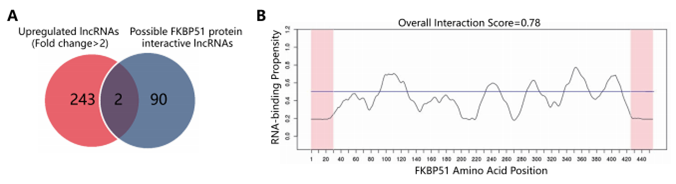
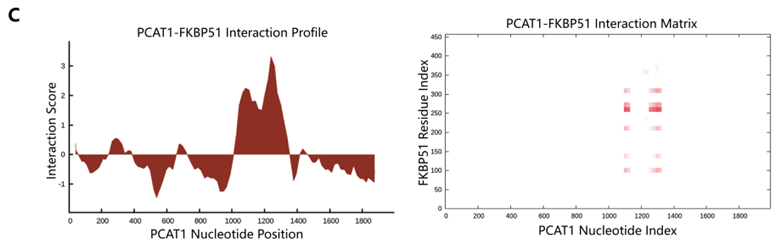
作者通过catRAPID软件对Arraystar Human LncRNA芯片结果中243个上调的LncRNA(FC>2.0,P<0.01)是否可以与FKBP51相互作用进行预测分析,发现LncRNA PCAT1即为其中的一个。catRAPID中相互作用谱,相互作用矩阵等预测结果均显示PCAT1与FKBP51相互作用的高度可能性(下图A-C)。接下来RNA pull down实验,作者发现在LNCaP-AI细胞中,PCAT1/FKBP51/IKKα可以结合形成复合物。并且RIP实验结果也进一步证实LNCaP-AI细胞中PCAT1/FKBP51间的相互作用关系(下图D,E)。
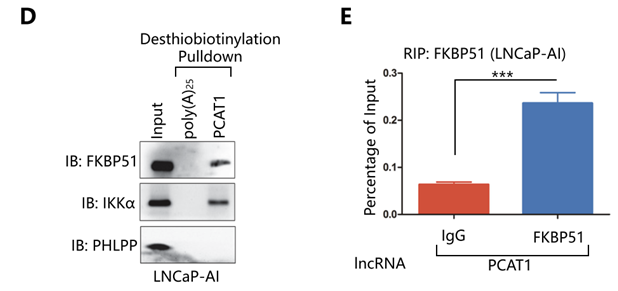
LncRNA-PCAT1-FKBP51间的相互作用影响FKPB51-IKKα-PHLPP蛋白复合体在去势抵抗性前列腺癌中的作用
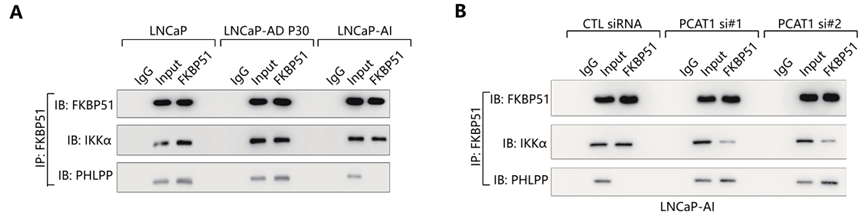
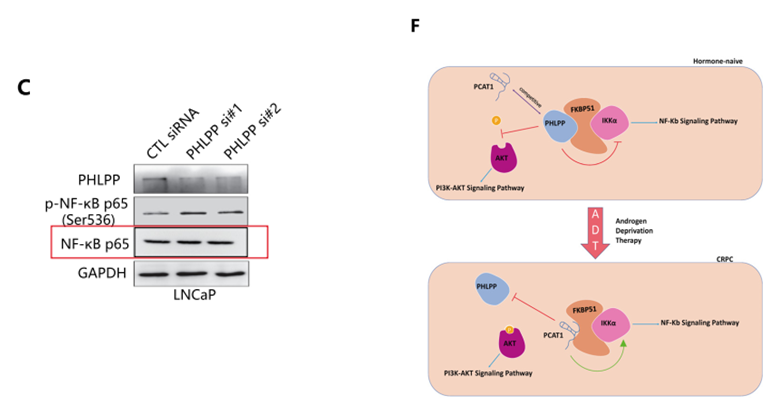
作者以预测出的PCAT1/FKBP51相互作用域和已知的FKBP51/PHLPP蛋白复合体间的相似作用区域为出发点,提出PCAT1可能通过与PHLPP竞争,进而结合FKBP51的观点。接下来,作者通过免疫共沉淀实验,发现在LNCaP,LNCaP-AD P30细胞中,PHLPP可与FKBP51蛋白结合,共同发挥作用,而在PCAT1表达较高的LNCaP-AI细胞中,并未检测到PHLPP与FKBP51的结合,该结果提示我们在缺乏雄激素的情况下,PCAT1可置换PHLPP蛋白,代替其发挥作用(图A);进而在雄激素非依赖性LNCaP-AI细胞中发现,敲降PCAT1可以恢复FKBP51/PHLPP蛋白相互结合的状态,同时减弱FKBP51/ IKKα间的相互作用(图B)。PCAT1的缺失,并不影响FKBP51, PHLPP以及 IKKα的表达水平(图F),却导致磷酸化NF-κB-p65表达水平的升高(图C)。
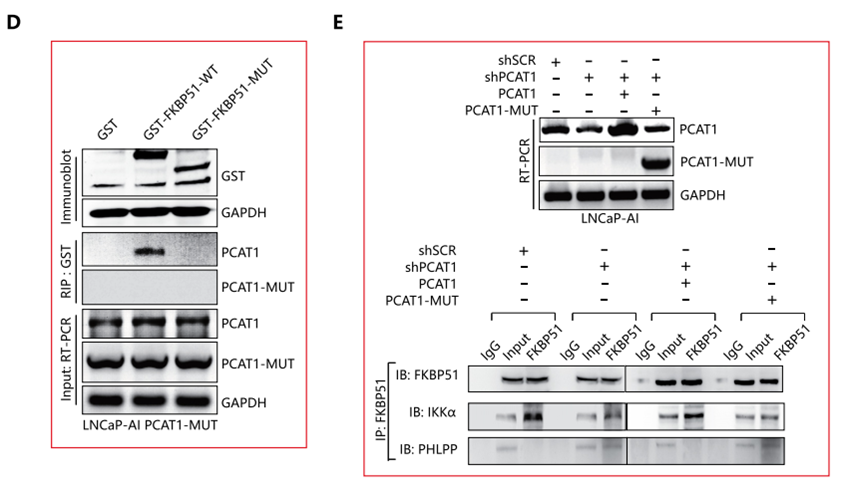
PCAT1/FKBP51间的相互作用的进一步证实
作者首先通过PCAT1截断突变体(Δ1001–1400bp)的一系列实验证明,预测的PCAT-1相互作用序列介导的FKBP51相互作用的重要性。接着通过RIP,免疫共沉淀,RT-PCR等一系列实验,证实保持两者的野生型状态和特定的结合位点是PCAT1与FKBP1发挥相互作用的关键(下图D,E)。
PCAT1在调控FKPB51-IKKα-PHLPP蛋白复合体时的作用模式
由此作者提出一种观点:在去势抗性前列腺癌中,PCAT1直接与FKBP51相互作用,竞争性抑制PHLPP对AKT信号通路的负调控,而PCAT1/FKBP51结合进一步稳定FKBP51/IKKα复合物,最终激活NF-κB信号通路,相关的作用模式图如下所示。
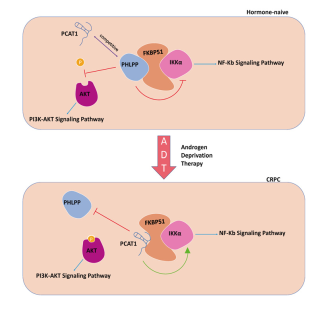
总结:LncRNA-PCAT1以PCAT1-FKPB51-IKKα复合体的模式发挥作用,激活去势抵抗性前列腺癌中的AKT和NF-κB信号通路。
LncRNA-PCAT1介导去势性细胞系的生长增殖
作者接着通过GOF&LOF功能实验,探究PCAT1/FKBP51在去势抵抗性前列腺癌发生发展中发挥的作用。作者在两种雄激素非依赖性细胞系LNCaP-AI和C4-2中分别干扰了PCAT1的表达,MTT实验和克隆形成实验表明,敲降PCAT1抑制了这两种细胞的增殖(图A);后续的免疫荧光实验进一步证实了这一结论(图C-G)。而过表达PCAT1则明显促进这两种细胞的生长,但FKBP51的敲除可以在不改变PCAT1表达量的情况下,逆转这一过度增殖效应(图B,H)。
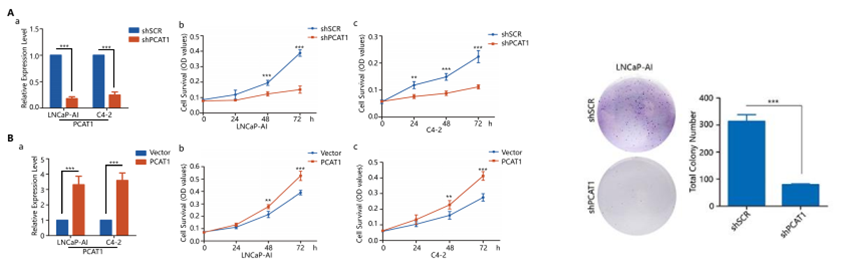
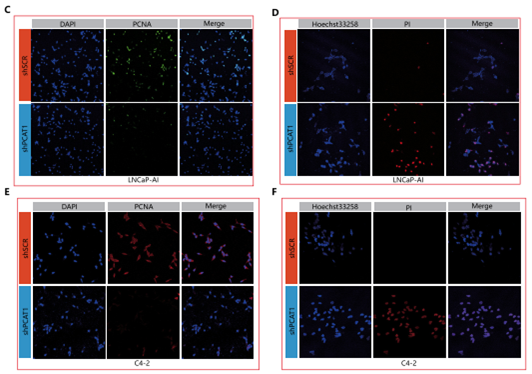
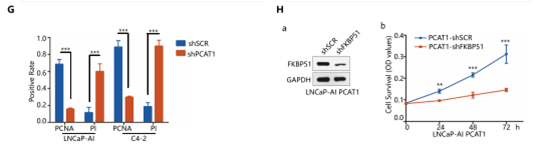
以上细胞功能实验的结果,再次证明了PCAT1/FKBP51互相作用的重要性。
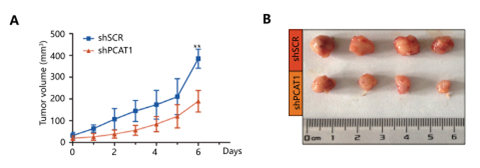
LncRNA-PCAT1可以抑制临床前小鼠模型中去势抵抗性前列腺癌的进展
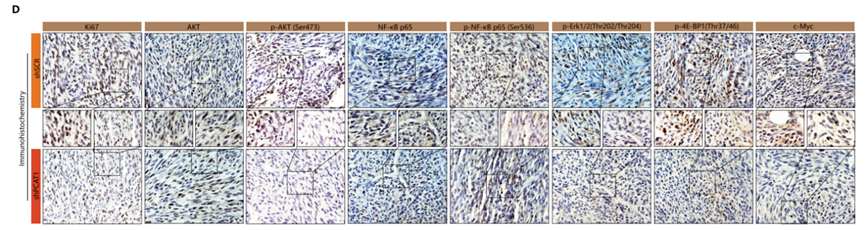
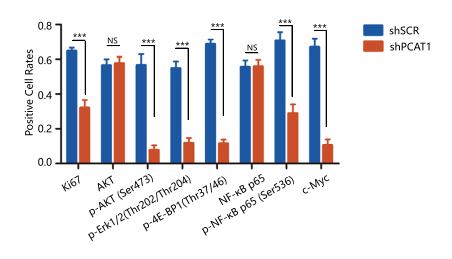
最后,为了研究体内情况下,LncRNA-PCAT1在去势抵抗性前列腺癌发展中的作用。作者构建了裸鼠移植瘤模型,并在成瘤后对两组裸鼠进行治疗。结果与体外细胞实验保持一致:与对照组相比,注射LncRNA-PCAT1 shRNA慢病毒治疗组的裸鼠,移植瘤的体积明显变小,同时免疫组化结果中ki67,p-AKT, NF-κB-p65以及AKT和NF-κB信号通路下游基因的蛋白水平也明显下调。
研究总结:
作者应用Arraystar Human LncRNA芯片锁定了一个在去势抵抗性前列腺癌中表达上调的LncRNA PCAT1。之后发现LncRNA-PCAT1可以激活去势抵抗性前列腺癌中的AKT和NF-κB信号通路,接着作者验证出LncRNA PCAT1是与 FKBP51相互作用的,并且是通过PCAT1-FKPB51-IKKα复合体的模式发挥作用,最后通过GOF和LOF功能实验以及体内实验,再次证实了这一观点。作者的研究为去势抵抗性前列腺癌的潜在生物标志物以及潜在治疗靶点提供了有价值的研究思路。
原文链接:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6486551/

