

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
浙江大学医学院第一附属医院刁宏燕教授长期从事感染性疾病的机制研究,课题组采用Arraystar human mRNA&LncRNA Epitranscriptomic 芯片筛选发现RBM15通过调控重症和轻症COVID-19感染患者的m6A修饰谱,影响感染患者的免疫反应程度。联合分析发现,m6A修饰与表达量同时上调的基因,显著富集于程序性细胞死亡和免疫反应相关的生物学过程中。功能研究发现,COVID-19蛋白刺激T淋巴细胞后,HuT 78细胞的凋亡能力和炎症因子释放能力增加,增殖能力减弱。机制研究发现,RBM15在COVID-19感染后表达量上调,敲低RBM15可显著降低淋巴细胞凋亡,抑制程序性细胞死亡和免疫反应相关基因的表达。该研究成果“RBM15-mediated N6-methyladenosine modification affects COVID-19 severity by regulating the expression of multitarget genes”于2021年发表在学术期刊Cell Death and Disease上,IF:8.469。
研究背景
SARS-CoV-2,也称为COVID-19,从爆发以来,已经是世界上最关注的疾病之一,临床表现复杂,从无症状到严重的急性呼吸道综合征和多个器官衰竭都可能发生。但引起淋巴细胞减少和多器官衰竭的机制尚不清楚,因此深入研究COVID-19感染导致人体产生症状的分子机制,成功找到有效的靶向药物治疗新冠感染,是当务之急的重要大事。
RNA N6-甲基腺嘌呤(m6A)修饰可以通过改变固有免疫信号分子的表达和重塑T细胞稳态,从而调控免疫反应和病毒感染。比如Socs1和Socs3的m6A修饰可影响T细胞分化和增殖;人巨细胞病毒感染时,m6A修饰酶METTL3/METTL14的缺失,将上调IFNβ的表达,这些结果都预示着m6A修饰可以作为抗病毒感染的治疗靶点。
研究思路:
文章着重于研究m6A修饰在COVID-19感染病人中的主要功能和修饰靶点,作者运用Arraystar human mRNA&LncRNA Epitranscriptomic 芯片检测了COVID-19感染后重症、轻症和无感染对照组(n=3)病人的外周血PBMC细胞中RNA的m6A修饰谱,利用差异倍数和p值筛选后,将修饰水平和表达水平同时上调的基因取交集并进行富集分析,发现m6A修饰和表达量有差异的基因主要富集在程序性细胞死亡和免疫反应的生物学过程中。
功能分析发现,使用COVID-19的S蛋白刺激HuT 78(人T淋巴细胞系),细胞的m6A修饰整体水平升高,细胞凋亡数目增加,凋亡和炎症相关基因表达升高,细胞增殖能力下降,说明m6A甲基化修饰在COVID-19感染过程中起到关键的调控作用。
机制研究发现,利用表达谱数据分析发现COVID-19感染的病人外周血PBMC中多个m6A相关蛋白的RNA丰度明显发生变化。使用COVID-19的S蛋白刺激后,HuT 78细胞中RBM15表达升高。敲低RBM15,m6A整体修饰程度下降。使用S蛋白刺激后,RBM15敲低的样本中,凋亡和炎症相关基因的m6A修饰程度降低,同时表达量也降低,意味着在COVID-19感染的病人中,RBM15通过介导m6A修饰,调控感染后T细胞的凋亡程度和炎症因子的释放。
技术路线:

结果展示:
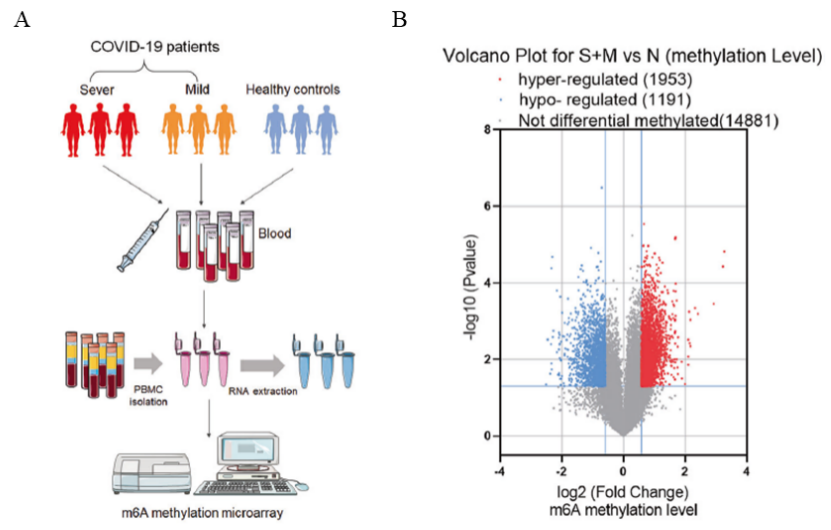
图1:Arraystar human mRNA&LncRNA Epitranscriptomic芯片的高通量筛选流程图和结果。
A:Arraystar human mRNA&LncRNA Epitranscriptomic Array高通量筛选流程图;
B:差异修饰基因的火山图。
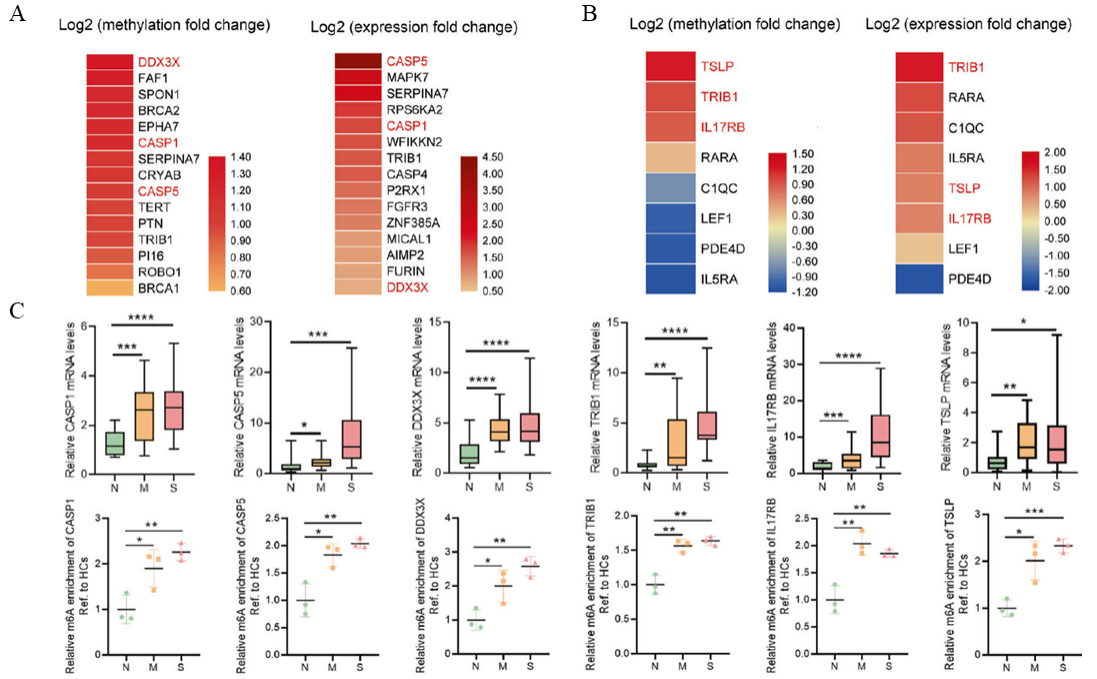
图2:m6A差异修饰的基因与表达量差异的基因显著富集于程序性细胞死亡和免疫反应相关通路中。
A:富集于程序性细胞死亡通路基因的m6A修饰差异倍数和表达量差异倍数热图;
B:富集于免疫反应通路基因的m6A修饰差异倍数和表达量差异倍数热图;
C:MeRIP-PCR和RT-qPCR验证程序性细胞死亡相关基因和免疫反应相关基因的m6A修饰程度和表达量。
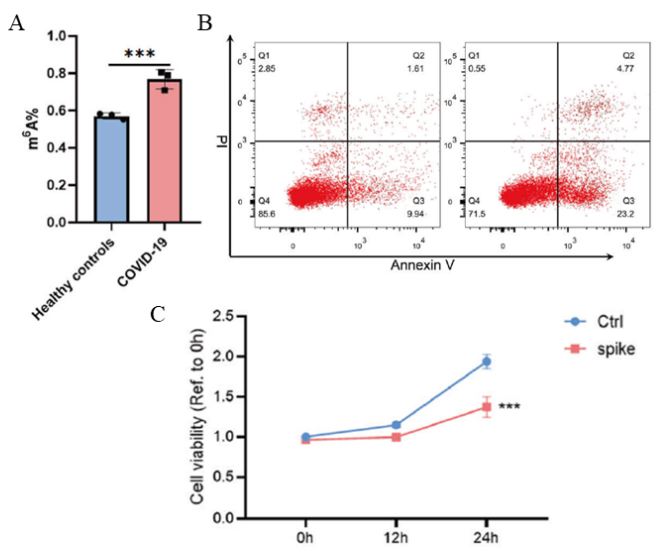
图3:m6A修饰调控T淋巴细胞的凋亡和增殖。
A:COVID-19刺激HuT 78后,m6A整体修饰水平升高;
B:COVID-19刺激HuT 78后,细胞凋亡数目数目增加;
C:COVID-19刺激HuT 78后;细胞增殖能力减弱。
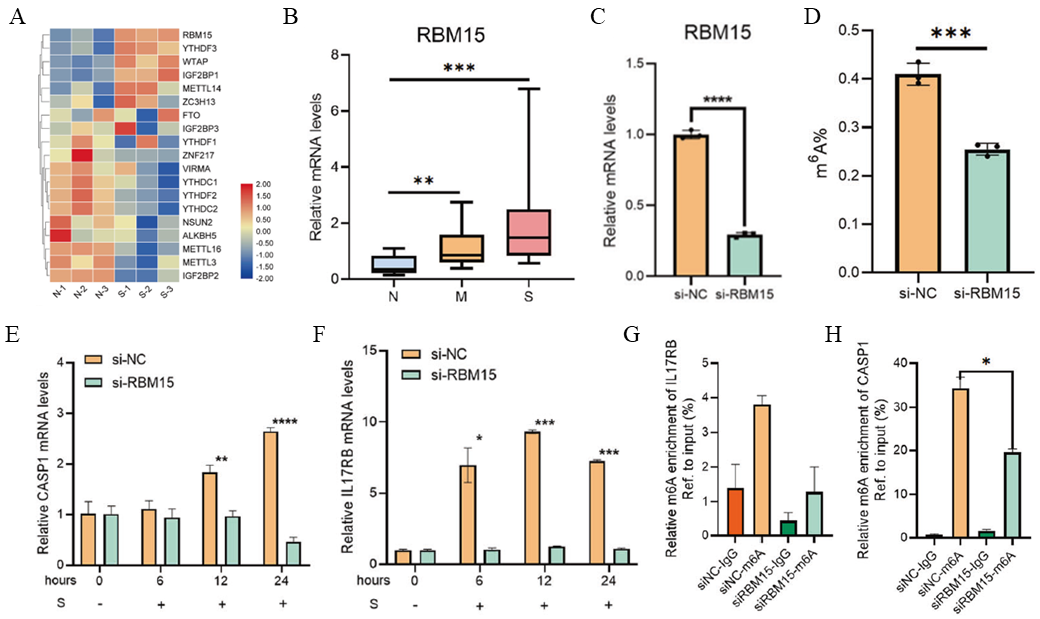
图4:RBM15介导淋巴细胞的m6A修饰调控COVID-19相关的免疫反应。
A:芯片结果显示,多个m6A相关基因,在COVID-19感染后表达发生变化;
B:RT-qPCR验证COVID-19感染后,RBM15表达升高;
C:RT-qPCR验证RBM15敲低效果;
D:HuT 78细胞中敲低RBM15后,m6A整体修饰水平降低;
E:敲低RBM15后,S蛋白刺激HuT 78细胞,凋亡相关基因CASP1表达降低;
F:敲低RBM15后,S蛋白刺激HuT 78细胞,炎症相关基因IL17RB表达降低;
G:敲低RBM15后,S蛋白刺激HuT 78细胞,凋亡相关基因CASP1的m6A修饰水平降低;
H:敲低RBM15后,S蛋白刺激HuT 78细胞,炎症相关基因IL17RB的m6A修饰水平降低。
研究意义:
本研究使用Arraystar human mRNA&LncRNA Epitranscriptomic 芯片研究COVID-19感染后重症和轻症病人外周血PBMC细胞中,m6A修饰以及表达量具有差异的基因及功能。发现COVID-19感染后,RBM15表达明显升高,引起凋亡和炎症相关基因的m6A修饰水平升高,导致相关基因的表达量升高,从而介导了T淋巴细胞的凋亡,并释放炎症因子,引起严重的免疫反应。该结果不仅仅探讨了m6A修饰与COVID-19感染的相关性,也为后续靶向治疗COVID-19感染的药物研发提供了新的思路。
原文出处:

