

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
circRNA是通过反向剪切形成的特殊类型的环形RNA分子,它通过调控基因转录和剪切[1,2]、编码小肽[3,4]以及利用其miRNA结合位点吸附miRNA[5,6]来发挥生物学功能。与mRNA类似,m6A也是circRNA内部最丰富的表观转录组修饰[7]。从生成机制上看,circRNA的m6A修饰主要由m6A修饰酶Mettl3和Mettl14添加并被去修饰酶FTO和ALKBH5可逆性的去除。
m6A修饰在维持circRNA生物学活性上具有重要的功能。m6A修饰除了具有调节circRNA稳定性的经典功能之外[7],还可以通过调控circRNA与miRNA互作来影响circRNA作为miRNA吸附海绵的功能,或者是影响circRNA和RNA结合蛋白(RBP)之间的相互作用[8],此外还可以标记内源RNA,从而将其与外源RNA区分开,避免被自身免疫系统识别攻击[9]。
值得注意的是,一个circRNA所有转录本上m6A的修饰比例在同一细胞中经常发生改变。而同一个circRNA的不同修饰比例(修饰化学计量数的比值)可能导致细胞具有不同的命运,因此确认circRNA修饰百分比与其功能后果高度相关[10,11]。
m6A调控circRNA稳定性的经典功能
环状RNA上m6A修饰的经典功能就是调控对应RNA的稳定性。从机制上看,主要利用了YTHDF2读取circRNA的m6A修饰,随后该蛋白结合HRSP12衔接蛋白并招募核糖核酸内切酶RNaseR/MRP,核酸内切酶切开RNA环,导致m6A修饰的circRNA迅速降解(图1)[12]。
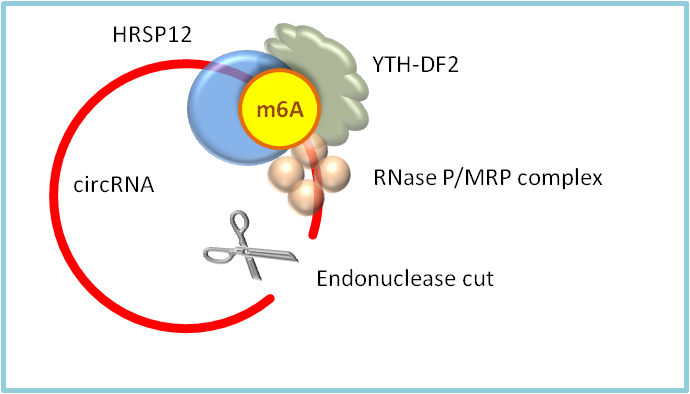
图1. YTHDF2可以读取m6A,将HRSP12衔接蛋白和RNase P/MRP复合物招募至YTHDF2结合位点上游的HRSP12结合位点和下游的RNase P/MRP切割位点。circRNA进而被切开并快速降解。
m6A的其他非经典功能
circRNA的m6A修饰促进非帽依赖的翻译
circRNAs是共价的RNA环状结构,没有5’或 3’的游离末端。由于缺少5’端的m7G 帽子结构,不能像mRNA一样招募翻译起始复合物,因此大部分的circRNA不具有编码蛋白的能力。但是,一些circRNA内部含有m6A修饰位点,通过与YTHDF3识别蛋白结合,也可以招募翻译起始复合物开始翻译蛋白(图 2) [13]。目前环状RNA通过质谱鉴定的由非帽依赖产生的多肽产物已有上百种。
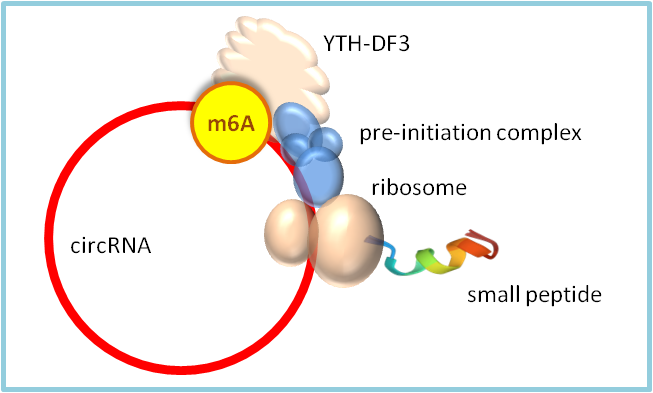
图2. circular RNA的m6A修饰 促进非帽依赖的蛋白翻译。识别蛋白YTHDF3结合circRNA m6a修饰位点,进而招募翻译起始因子4G2,4A,4B以及40S核糖体小亚基形成43S转录起始复合物,导致circRNA的非帽依赖翻译发生 [13]。
circRNA的m6A修饰调控circRNA与RNA结合蛋白(RBP)的相互作用
circNSUN2是一个通常在伴随肝转移的结直肠癌中表达上调的circRNA。circNSUN2的m6A修饰促进circNSUN2转运到细胞质,在细胞质中m6A修饰的circNSUN2引导IGF2BP2结合HMGA2 mRNA,促进circNSUN2/IGF2BP2蛋白/HMGA2 mRNA三元复合物形成,从而增强HMGA2 mRNA稳定性并促进HMGA2翻译(图3)[14]。
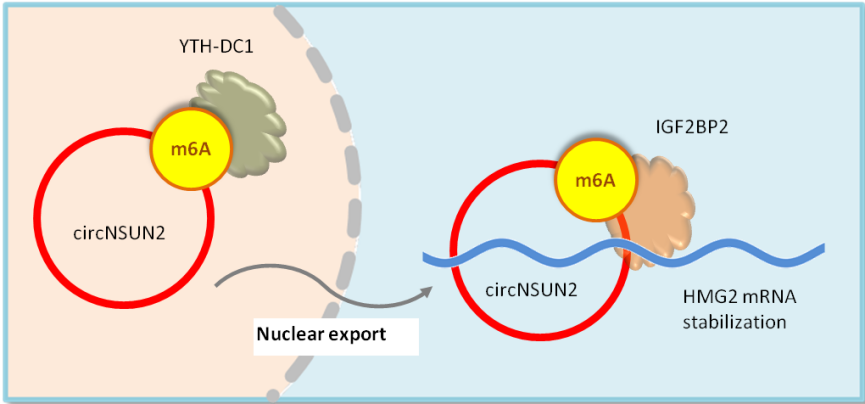
图3. circNSUN2的m6A修饰促进circNSUN2转运到细胞质。在细胞质中,m6A修饰的circNSUN2促进circNSUN2/IGF2BP2蛋白/HMGA2 mRNA三元复合物形成,从而增强HMGA2 mRNA稳定性并促进HMGA2翻译。HMGA2上调促进结直肠癌转移进程[14]。
circRNA m6A修饰与ceRNA机制
circRNA的m6A修饰与癌症密切相关,因为circRNA通常具有多个microRNA结合位点,能够结合microRNA并抑制其发挥功能。而已知许多microRNA则能作为促癌microRNA参与癌症的发生发展,m6A修饰就能够影响circRNA与microRNA的结合。
m6A控制“自身的”和“外来的”circRNA免疫
外源circRNAs(例如病毒RNA来源)可以通过宿主防御促进抗病毒基因表达(例如干扰素)以及引发强烈的免疫反应。然而,由于生物体内也存在类似的circRNA分子。因此如何识别内源性circRNA,避免其引发不恰当的免疫反应就是一个很重要的问题。关于这一问题,目前有研究表明,内源性的circRNA会发生m6A修饰,被YTH蛋白读取,从而被识别为“自身的”分子,进一步抑制促进干扰素产生的视黄酸诱导基因I(RIG-I)的激活[9]。因此,m6A可作为识别“自身”与“外源”circRNA的标记。
另一个案例是HPV病毒来源的环状RNA circE7。m6A修饰赋予circE7翻译转化的原癌蛋白的能力[15],同时m6A标记circE7为“自身的”来帮助病毒逃脱宿主的抗病毒免疫反应。
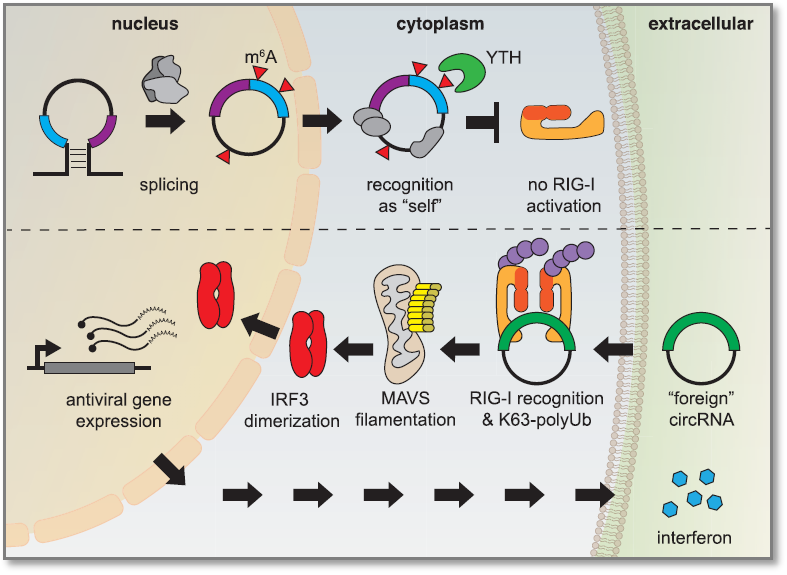
图4. m6A修饰的内源circRNA被YTHDF2识别为“自身的”分子,进而阻断RIG-I的激活。未经m6A修饰的外源circRNA在K63连接的多聚泛素分子存在的情况下激活RIG-I,从而导致抗病毒信号通路的激活和干扰素的产生[9]。
m6A在circRNA中的功能不仅限于RNA稳定性,而且在多肽翻译、circRNA-miRNA吸附海绵、circRNA-RBP结合、circRNA核转运、靶mRNA周转和circRNA免疫方面均具有功能。因此对circRNA进行m6A修饰筛选开辟了表观转录组学的一个新的研究领域。
参考文献
[1] Li, Z., et al. (2015) "Exon-intron circular RNAs regulate transcription in the nucleus" Nat Struct Mol Biol 22(3):256-64 [PMID: 25664725]
[2] Conn, V. M., et al. (2017) "A circRNA from SEPALLATA3 regulates splicing of its cognate mRNA through R-loop formation" Nat Plants 3:17053 [PMID: 28418376]
[3] Pamudurti, N. R., et al. (2017) "Translation of CircRNAs" Mol Cell 66(1):9-21 e7 [PMID: 28344080]
[4] Yang, Y., et al. (2018) "Novel Role of FBXW7 Circular RNA in Repressing Glioma Tumorigenesis" J Natl Cancer Inst 110(3[PMID: 28903484]
[5] Han, D., et al. (2017) "Circular RNA circMTO1 acts as the sponge of microRNA-9 to suppress hepatocellular carcinoma progression" Hepatology 66(4):1151-1164 [PMID: 28520103]
[6] Chen, X., et al. (2018) "PRMT5 Circular RNA Promotes Metastasis of Urothelial Carcinoma of the Bladder through Sponging miR-30c to Induce Epithelial-Mesenchymal Transition" Clin Cancer Res 24(24):6319-6330 [PMID: 30305293]
[7] Zhou, C., et al. (2017) "Genome-Wide Maps of m6A circRNAs Identify Widespread and Cell-Type-Specific Methylation Patterns that Are Distinct from mRNAs" Cell Rep 20(9):2262-2276 [PMID: 28854373]
[8] Huang, A., et al. (2020) "Circular RNA-protein interactions: functions, mechanisms, and identification" Theranostics 10(8):3503-3517 [PMID: 32206104]
[9] Chen, Y. G., et al. (2019) "N6-Methyladenosine Modification Controls Circular RNA Immunity" Mol Cell [PMID: 31474572]
[10] Lewis, C. J., et al. (2017) "RNA modifications and structures cooperate to guide RNA-protein interactions" Nat Rev Mol Cell Biol 18(3):202-210 [PMID: 28144031]
[11] Gilbert, W. V., et al. (2016) "Messenger RNA modifications: Form, distribution, and function" Science 352(6292):1408-12 [PMID: 27313037]
[12] Park, O. H., et al. (2019) "Endoribonucleolytic Cleavage of m(6)A-Containing RNAs by RNase P/MRP Complex" Mol Cell 74(3):494-507 e8 [PMID: 30930054]
[13] Yang, Y., et al. (2017) "Extensive translation of circular RNAs driven by N(6)-methyladenosine" Cell Res 27(5):626-641 [PMID: 28281539]
[14] Chen, R. X., et al. (2019) "N(6)-methyladenosine modification of circNSUN2 facilitates cytoplasmic export and stabilizes HMGA2 to promote colorectal liver metastasis" Nat Commun 10(1):4695 [PMID: 31619685]
[15] Zhao, J., et al. (2019) "Transforming activity of an oncoprotein-encoding circular RNA from human papillomavirus" Nat Commun 10(1):2300 [PMID: 31127091]
康成生物丨数谱生物 非编码RNA m6A修饰研究解决方案
RNA m6A修饰表达谱检测——Arraystar表观转录组芯片
不仅能在转录本水平上对m6A修饰进行定量,还能检测每个转录本修饰亚群和非修饰亚群的百分比
(1)mRNA&lncRNA 表观转录组芯片:适用于mRNA、lncRNA、pre-miRNA, pri-miRNA, snoRNA, 和 snRNA;total RNA要求量可低至1ug。
(2)CircRNA 表观转录组芯片:适用于circRNA m6A检测;total RNA要求量可低至3ug。
lncRNA m6A 甲基化PCR验证:
(1)转录本水平验证lncRNA 的m6A 修饰:m6A抗体富集发生m6A修饰RNA(RNA不作片段化处理) + lncRNA转录本特异性PCR检测
(2)基于MazF 酶处理的lncRNA m6ACA位点检测:lncRNA m6ACA位点预测 + MazF酶处理 + m6ACA位点PCR检测
circRNA m6A 甲基化PCR验证:
(1)环状RNA m6A 修饰验证:m6A抗体富集发生m6A修饰的RNA + RNase RNA消化线性RNA,保留circRNA +circRNA反向接合位点设计引物
(2)基于MazF 酶处理的circRNA m6ACA位点检测:circRNA m6ACA位点预测 + RNase R去线性RNA + MazF酶处理 + m6ACA位点PCR检测

