

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
GlycoRNA已经成为癌症、心血管疾病、神经系统疾病、免疫系统疾病以及呼吸系统疾病等领域的一个新兴研究方向,为新型生物标志物和治疗应用打开了新机遇。
乳腺癌
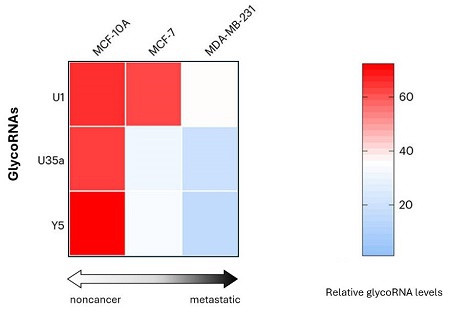
定位于细胞表面的glycoRNAs与肿瘤恶性程度和转移呈负相关。例如乳腺非癌细胞系MCF-10A具有最高水平的糖基化RNA,其次是乳腺癌细胞系MCF-7,而乳腺转移性癌细胞系MDA-MB-231则表现出最低水平[1](见图1)。这种负相关关系表明这些glycoRNAs可以作为乳腺癌进展和转移的生物标志物。
胰腺癌
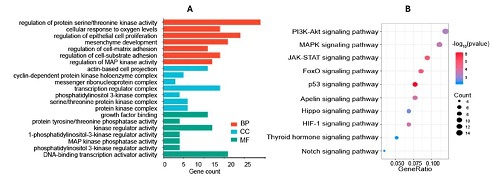
已经确定特定的糖基化miRNA作为胰腺癌细胞生长和增殖的调控因子[2]。例如,糖基化的miR-103a-3p、miR-122-5p和miR-4492可以通过PI3K-Akt途径调控胰腺癌细胞的生长和增殖[2-3](图2)。此外,通过影响糖基化miRNA(如hsa-miR-21-5p)的表达,β-1,4-半乳糖转移酶1(B4GALT1)可以抑制MIA PaCa-2胰腺癌细胞的细胞周期并促进凋亡。因此,B4GALT1可能是这些miRNA的糖基化酶[3]。
心血管疾病
Y-RNAs是一类高度保守的小的非编码RNA(约110nt),是糖基化的主要靶标[6-7]。它们在免疫调节中扮演着重要角色。Y-RNAs在人体内占循环RNA的60%以上,它们的水平与动脉粥样硬化的进展呈正相关,而后者是缺血性中风的主要风险因素[4-5]。Y-RNA片段可以激活巨噬细胞并在动脉粥样硬化过程中促进炎症[5]。这些结果表明,糖基化的Y-RNAs可能是心血管疾病的风险因素和生物标志物。
中风
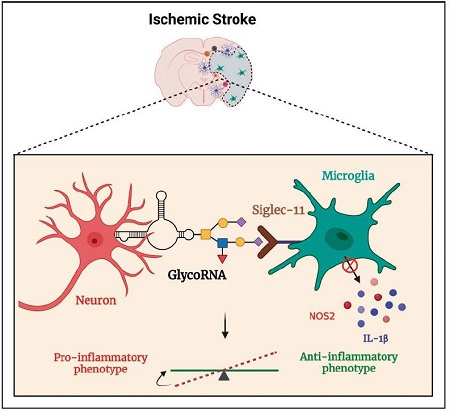
GlycoRNA能够调节缺血性脑部的炎症反应[10](图3)。类似于神经元糖蛋白,glycoRNA可作为小胶质细胞Siglec-11受体的配体,通过降低IL-1b等细胞因子和生成一氧化氮的NOS2的表达来使细胞极化为抗炎表型。靶向glycoRNA可能是中风治疗和康复有前景的途径。
免疫调节
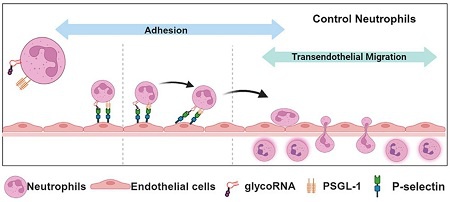
已经发现glycoRNA能与免疫细胞受体相互作用,特别是与唾液酸结合免疫球蛋白类似凝集素(Siglec)受体家族成员[6]。中性粒细胞表面的glycoRNA对于调节中性粒细胞与内皮细胞的粘附、促进经内皮细胞迁移以及控制中性粒细胞招募至关重要[8](见图4)。此外,与Sele不同,凝集素Selp可以识别至少一部分中性粒细胞glycoRNA。因此,作为Selp的glycoRNA配体可能具有特异性,即使在高度相似的凝集素蛋白家族中也是如此[8]。免疫细胞上的glycoRNA可能对各种免疫相关疾病和自身免疫疾病具有广泛的影响。
肺泡上皮功能
GlycoRNA代表了肺泡上皮糖包被中的一种新组分,用于调节上皮屏障功能或影响流感病毒感染[9]。已确定glycoRNA作为唾液酸结合免疫球蛋白类似凝集素(siglec)11和14的配体在免疫细胞(包括巨噬细胞、单核细胞和中性粒细胞)上的功能,可能影响肺炎中免疫细胞相互作用[6]。此外,肺泡上皮细胞表面的glycoRNA可能与肺表面活性蛋白A(SPA)和D(SPD)相互作用,进一步参与呼吸道免疫反应[9]。因此,在支气管肺泡灌洗液中分析脱落的glycoRNA,可能为评估上皮损伤和破坏提供有价值的生物标志物。
相关服务
GlycoRNA芯片技术服务
相关综述
什么是糖基化RNA(GlycoRNA)?
如何研究GlycoRNAs?
参考文献
1.Ma Y. et al (2024) "Spatial imaging of glycoRNA in single cells with ARPLA" Nat Biotechnol 42(4):608-616 [PMID:37217750]
2.Li, J. et al (2024) "O-Glycosylated RNA Identification and Site-specific Prediction by Solid-phase Chemoenzymatic TnORNA method and PONglyRNA tool" bioRxiv [doi: https://doi.org/10.1101/2024.06.18.599663]
3.Li J. et al (2023) "Novel Approach to Enriching Glycosylated RNAs: Specific Capture of GlycoRNAs via Solid-Phase Chemistry." Anal Chem 95(32):11969-11977 [PMID:37524653]
4.Driedonks TAP. and Nolte-'t Hoen ENM. (2018) "Circulating Y-RNAs in Extracellular Vesicles and Ribonucleoprotein Complexes; Implications for the Immune System." Front Immunol 9:3164 [PMID:30697216]
5.Hizir Z. et al (2017) "RNY (YRNA)-derived small RNAs regulate cell death and inflammation in monocytes/macrophages." Cell Death Dis 8(1):e2530 [PMID:28055017]
6.Flynn RA. et al (2021) "Small RNAs are modified with N-glycans and displayed on the surface of living cells." Cell 184(12):3109-3124.e22 [PMID:34004145]
7.Flynn, RA. et al (2019) "Mammalian Y RNAs are modified at discrete guanosine residues with N-glycans." bioRxiv [https://doi.org/10.1101/787614]
8.Zhang N. et al (2024) "Cell surface RNAs control neutrophil recruitment." Cell 187(4):846-860.e17 [PMID:38262409]
9.Abledu, JK. et al (2024) "Cell surface RNA expression modulates alveolar epithelial function." bioRxiv [https://doi.org/10.1101/2024.05.19.594844]
10. Chokkalla AK. et al (2023) "Immunomodulatory role of glycoRNAs in the brain." J Cereb Blood Flow Metab 43(4):499-504 [PMID:36644904]

