单细胞测序助力肿瘤异质性研究新思路
肿瘤组织样本中的细胞类型异质性(ITH)
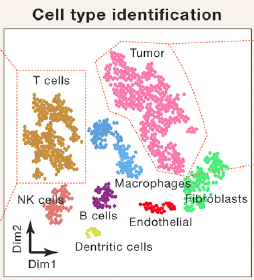
肿瘤组织不仅由肿瘤细胞组成,还包括基质细胞(成纤维细胞和内皮细胞)和免疫细胞,如T细胞,NK细胞B细胞,树突状细胞和巨噬细胞[1]。为了获得肿瘤细胞特异性RNA表达水平,我们应该将肿瘤细胞与基质细胞和免疫细胞分开。
单细胞测序(scRNA-seq)通过tSNE图聚类分析将肿瘤细胞与其他基质和免疫细胞分离并特异性定量肿瘤细胞RNA表达水平,同时,通过基因集变异分析(GSVA)获得肿瘤细胞特异性激活的通路,被证明是一种强大的检测工具。
图1. scRNA-seq通过t-SNE图鉴定并区分肿瘤细胞与其他基质和免疫细胞[1]
区分不同细胞亚群后,scRNA-seq可提供肿瘤细胞特异性差异表达分析,以确定肿瘤细胞在疾病治疗或进展等过程中是否具有基因表达的差异。
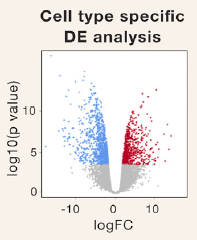 图2. scRNA-seq火山图展示肿瘤特异性差异表达基因 [1]
图2. scRNA-seq火山图展示肿瘤特异性差异表达基因 [1]
通过GSVA分析恶性与非恶性上皮细胞比较中显著富集的通路。
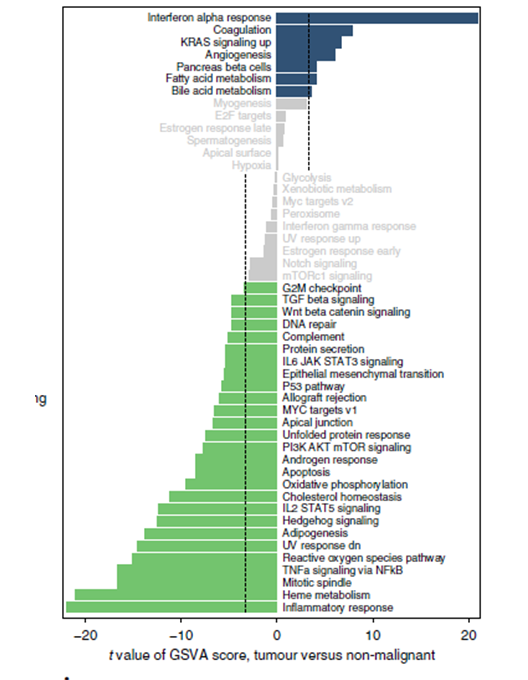 图3. 使用GSVA分析对肿瘤细胞和正常上皮细胞(3873个肿瘤细胞与4201个正常上皮细胞)中每个细胞的通路活跃度差异进行评分。T 值来自线性模型,校正了不同患者来源的影响[2]。
图3. 使用GSVA分析对肿瘤细胞和正常上皮细胞(3873个肿瘤细胞与4201个正常上皮细胞)中每个细胞的通路活跃度差异进行评分。T 值来自线性模型,校正了不同患者来源的影响[2]。
肿瘤细胞异质性
与不同细胞正常分化导致的细胞间异质性相比,不同肿瘤细胞即使处在相似的不同分化阶段,同样也显示出更大的细胞间异质性。这种增加的细胞间差异很可能是由于肿瘤内部自身的基因组异质性导致的,或者是由于不正常/异质化的肿瘤微环境(相比于正常组织环境)提供给细胞的信号异质性导致的。除了由于基因组序列多样性以及肿瘤微环境异质性导致细胞差异之外,这些细胞间的差异也可能是由于整体表观基因组的变化造成的,这一现象已经在肿瘤细胞中被普遍报道[3]。(例如广泛的CpG岛低甲基化)。肿瘤细胞表型的多样性可能对肿瘤的侵袭和转移、对不同治疗方案的响应、整体疾病的进展有重要影响。 例如,在头颈部癌症中,也使用scRNA-seq鉴定了EMT状态的差异,其中不同的EMT状态与侵袭和转移扩散相关[4]。
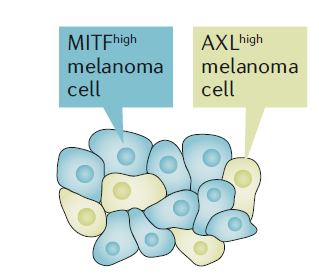 图4. 黑色素瘤细胞表型可塑性。 黑色素瘤中,不同转录状态或表型的细胞能够在同一个肿瘤组织中共存,进而使肿瘤整体上能够在高MITF表达状态(色素型)与高AXL表达状态(侵袭型)之间切换。与增殖相关的高MITF表达特征驱动初始肿瘤生长,然后肿瘤整体能够切换到侵袭性的高AXL表达状态,使其能够进一步侵袭和扩散。而在到达转移部位后又必须切换回增殖表型以促进生长。 小眼畸形相关转录因子(MITF)高表达肿瘤对MAP-激酶抑制剂(MAPKi)治疗有反应,因为BRAF介导的增殖和生存依赖于MITF [5]。
图4. 黑色素瘤细胞表型可塑性。 黑色素瘤中,不同转录状态或表型的细胞能够在同一个肿瘤组织中共存,进而使肿瘤整体上能够在高MITF表达状态(色素型)与高AXL表达状态(侵袭型)之间切换。与增殖相关的高MITF表达特征驱动初始肿瘤生长,然后肿瘤整体能够切换到侵袭性的高AXL表达状态,使其能够进一步侵袭和扩散。而在到达转移部位后又必须切换回增殖表型以促进生长。 小眼畸形相关转录因子(MITF)高表达肿瘤对MAP-激酶抑制剂(MAPKi)治疗有反应,因为BRAF介导的增殖和生存依赖于MITF [5]。
scRNA-seq方法已被证明是一种强大的工具,通过t-SNE图sub-cluster亚群分析区分癌细胞亚型并特异性定量特定癌症亚型的RNA表达水平。
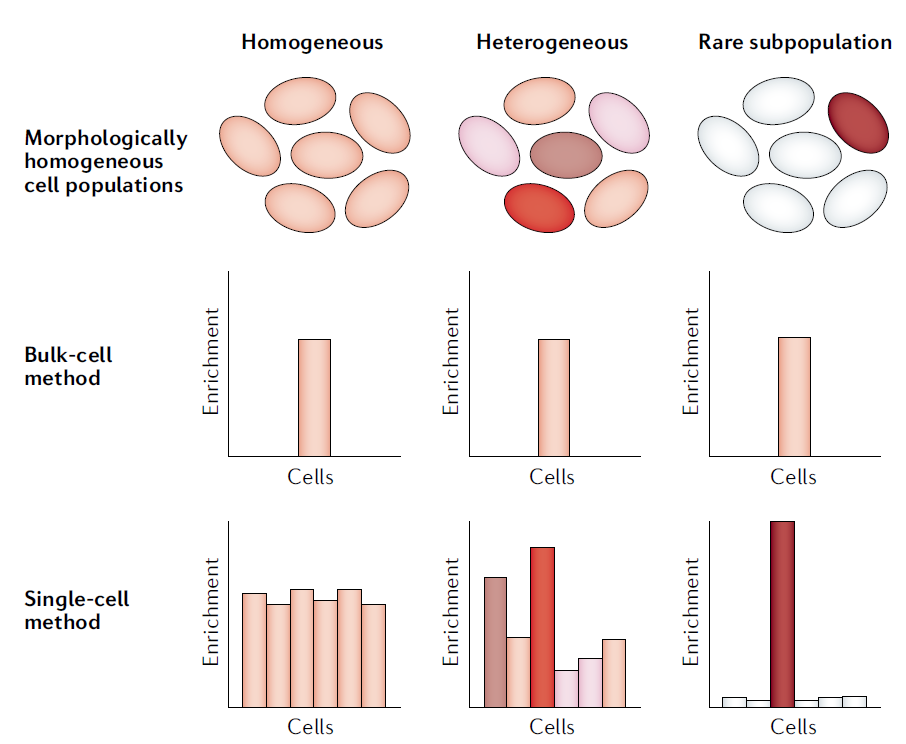 图5. 三种形态学上同质的肿瘤细胞亚群中,某个特定的RNA转录本在不同细胞亚型间表现出不同的表达模式,颜色较深表示该RNA表达水平较高。常规的bulk RNA测序只能检测RNA在整体细胞亚群中的平均表达值,无法区分不同的细胞亚型。相比之下,单细胞测序可以轻松地区分细胞亚型中的RNA是均质表达(左)、整体差异表达(中)还是具有稀有高表达(右)[6]。
图5. 三种形态学上同质的肿瘤细胞亚群中,某个特定的RNA转录本在不同细胞亚型间表现出不同的表达模式,颜色较深表示该RNA表达水平较高。常规的bulk RNA测序只能检测RNA在整体细胞亚群中的平均表达值,无法区分不同的细胞亚型。相比之下,单细胞测序可以轻松地区分细胞亚型中的RNA是均质表达(左)、整体差异表达(中)还是具有稀有高表达(右)[6]。
肿瘤微环境(TME)中的细胞异质性
TME主要分为免疫和基质细胞成分,这两者都可以使用scRNA-seq方法鉴定分析。在基质细胞类型中,成纤维细胞一直是一种令人感兴趣的细胞类型,因为它们经常被重编程为癌相关成纤维细胞(CAFs)。在多种癌症中,scRNA研究揭示了在基质构建,血管生成和免疫调节方面具有不同功能的异质CAF亚型。另一种研究较多的基质细胞类型是内皮细胞,它可以被重编程为肿瘤内皮细胞(TECs),通过调节血管形成和调控免疫细胞来促进肿瘤进展。scRNA-seq方法可以解析内皮细胞的亚型,并揭示可以靶向的信号通路。由于免疫疗法在癌症治疗中越来越多的应用,TME中的免疫细胞目前是实体瘤中另一个热门研究领域。利用scRNA-seq来分析T细胞的多项研究表明,免疫抑制性微环境与预后不良有关,其中耗竭型T细胞的增加和激活型T细胞的减少与各种癌症的进展密切相关。此外,scRNA-seq揭示了组织驻留记忆T细胞在乳腺癌中具有更高的细胞毒性活性,并且与三阴性乳腺癌(TNBC)患者的良好预后相关。髓系细胞是TME的另一个组成部分,与几种癌症类型的患者预后有关。肿瘤相关巨噬细胞(TAMs)传统上被归类为M1(促炎)或M2(促癌)型,然而scRNA-seq数据表明,存在连续的巨噬细胞表达程序,TAMs具有多种细胞状态,从而对这种简单的分类提出了挑战[1]。 scRNA-seq方法已被证明是描绘TME和鉴定肿瘤中重编程的免疫和基质细胞类型的强大工具,这些细胞类型可以促进或抑制肿瘤生长或与治疗抵抗有关。 这些数据原则上可用于在临床环境中单独选择针对异常细胞类型的靶向疗法。
肿瘤相关成纤维细胞(CAFs)控制肿瘤细胞表型
CAFs是一系列分泌蛋白的来源,例如转化生长因子β(TGF β)或细胞外基质(ECM)蛋白,这些蛋白可以诱导肿瘤具有MITF低表达同时AXL高表达的侵袭表型。此外,衰老成纤维细胞的分泌组中一些额外的与细胞衰老相关的蛋白,如sFRP2,有助于MITF下调和诱导去分化的AXL高表达表型。
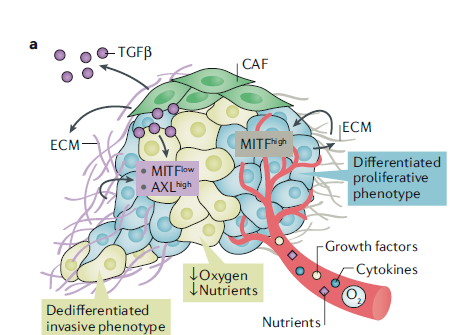 图6. 肿瘤相关成纤维细胞(CAFs)控制黑色素瘤细胞表型[5]
图6. 肿瘤相关成纤维细胞(CAFs)控制黑色素瘤细胞表型[5]
 图7. 肺癌与非恶性肺组织中1465个成纤维细胞的t-SNE图,图上的颜色表示了不同的成纤维细胞亚群(上图)或样品来源类型(下图)。 虽然成纤维细胞总体上仅在肿瘤中部分富集,但类群1在肿瘤中强烈富集(肿瘤相关成纤维细胞(CAFs)),类群6在非恶性样品中富集[2]。
图7. 肺癌与非恶性肺组织中1465个成纤维细胞的t-SNE图,图上的颜色表示了不同的成纤维细胞亚群(上图)或样品来源类型(下图)。 虽然成纤维细胞总体上仅在肿瘤中部分富集,但类群1在肿瘤中强烈富集(肿瘤相关成纤维细胞(CAFs)),类群6在非恶性样品中富集[2]。
 图8. T-SNE 图,图上颜色代表成纤维细胞不同细胞亚群的标记基因表达量(灰色至红色表达量逐渐升高)[2]。
图8. T-SNE 图,图上颜色代表成纤维细胞不同细胞亚群的标记基因表达量(灰色至红色表达量逐渐升高)[2]。
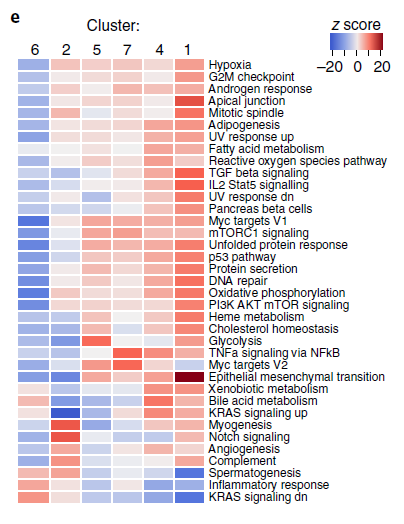 图9. GSVA通过单细胞层面分析得到不同成纤维细胞类群之间的通路活性差异。展示的是来自线性模型的 t 值,已针对患者来源进行了校正。类群2显示出与肌生成过程相关基因(例如,MEF2C,MYH11或ITGA7),NOTCH信号通路基因和血管生成相关基因的高表达,表明这些细胞被强烈激活。虽然类群5和类群7高度相似,都具有较弱的肌生成过程和较高的mTOR特征表达,但它们在糖酵解基因的表达上存在差异,表明存在代谢差异。此外,类群1和类群4相似,但类群1显示出强烈的上皮间充质转换信号,表达大量的细胞外基质蛋白和TGF-β相关基因[2]。
图9. GSVA通过单细胞层面分析得到不同成纤维细胞类群之间的通路活性差异。展示的是来自线性模型的 t 值,已针对患者来源进行了校正。类群2显示出与肌生成过程相关基因(例如,MEF2C,MYH11或ITGA7),NOTCH信号通路基因和血管生成相关基因的高表达,表明这些细胞被强烈激活。虽然类群5和类群7高度相似,都具有较弱的肌生成过程和较高的mTOR特征表达,但它们在糖酵解基因的表达上存在差异,表明存在代谢差异。此外,类群1和类群4相似,但类群1显示出强烈的上皮间充质转换信号,表达大量的细胞外基质蛋白和TGF-β相关基因[2]。
康成生物丨数谱生物可提供的技术服务
单细胞全转录组测序
参考文献:
[1] Lim B, Lin Y, Navin N. Advancing Cancer Research and Medicine with Single-Cell Genomics. Cancer Cell. 2020
[2] Lambrechts D, Wauters E, Boeckx B, Aibar S, Nittner D, Burton O, Bassez A, Decaluwé H, Pircher A, Van den Eynde K, Weynand B, Verbeken E, De Leyn P, Liston A, Vansteenkiste J, Carmeliet P, Aerts S, Thienpont B. Phenotype molding of stromal cells in the lung tumor microenvironment. Nat Med. 2018
[3] Marusyk A, Janiszewska M, Polyak K. Intratumor Heterogeneity: The Rosetta Stone of Therapy Resistance. Cancer Cell. 2020.
[4]Puram SV, Tirosh I, Parikh AS, Patel AP, Yizhak K, Gillespie S, Rodman C, Luo CL, Mroz EA, Emerick KS, Deschler DG, Varvares MA, Mylvaganam R, Rozenblatt-Rosen O, Rocco JW, Faquin WC, Lin DT, Regev A, Bernstein BE. Single-Cell Transcriptomic Analysis of Primary and Metastatic Tumor Ecosystems in Head and Neck Cancer. Cell. 2017.
[5] Arozarena I, Wellbrock C. Phenotype plasticity as enabler of melanoma progression and therapy resistance. Nat Rev Cancer. 2019
[6] Carter B, Zhao K. The epigenetic basis of cellular heterogeneity. Nat Rev Genet. 2021