

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
山东省第一医科大学宋现让教授课题组长期从事肿瘤分子诊断研究,近期该课题组发表了题为“SNORD88C guided 2'-O-methylation of 28S rRNA regulates SCD1 translation to inhibit autophagy and promote growth and metastasis in non-small cell lung cancer”的研究性论文,该文章采用snoRNA测序筛选发现SNORD88C在非小细胞肺癌(NSCLC)病人组织和血浆中表达上调,可作为非侵入诊断的分子标志物。In vivo和in vitro功能研究结果显示,SNORD88C可促进NSCLC的肿瘤生长增殖和侵袭转移。机制研究发现,SNORD88C可以促进28s rRNA C3680位的2’-O-甲基化修饰,进而促进rRNA的成熟,增强下游SCD1的翻译。SCD1是单不饱和脂肪酸MUFA的合成酶,通过调节脂质过氧化和mTOR来抑制自噬,为SNORD88C调控NSCLC提供了新思路。该研究成果于2022年发表于学术期刊Cell Death & Differentiation,影响因子为12.067(snoRNA测序由康成生物|数谱生物提供技术服务)。

研究背景
非小细胞肺癌NSCLC约占所有肺癌比例的85%,是一种高度恶性的肿瘤,尽管癌症治疗手段在不断完善,NSCLC患者在诊断后5年内存活率也只有16%,且约有2/3的患者出现转移。因此,迫切需要加深我们对NSCLC进展机制的理解,并确定有效的诊断分子标志物和新的治疗靶点。
SnoRNAs(核仁小RNA)是一类中等长度的非编码小RNA,一般长度在60-300nt,根据结构的区别可以将其分为两类:H/ACA box snoRNA(SNORA)和C/D box snoRNA(SNORDs)。SNORA与dyskerin蛋白形成snoRNP复合物,负责添加rRNA的假尿嘧啶(Ψ)修饰;SNORD与Fibrillarin (FBL)蛋白形成snoRNP复合物,介导rRNA的2'-O-甲基化(2'-O-me)修饰。snoRNA介导的rRNA修饰,特别是2'-O-me修饰,会影响核糖体生成、活性和翻译保真度,有助于调节肿瘤发生发展。
研究思路
作者分析了TCGA SNORic数据库中肺腺癌LUAD和肺鳞癌LUSC与癌旁差异表达的snoRNA,并利用snoRNA测序检测了4 vs.6 健康和NSCLC病人血浆中差异表达的snoRNA,两者取交集,发现SNORD88C在病人癌组织和血浆中均表达上调;扩大样本在TCGA组织及FFPE样本验证、临床血浆样本验证表明,SNORD88C在NSCLC疾病及疾病早期上调,进行ROC曲线分析来探究诊断效果,NSCLC中SNORD88C、早期NSCLC中SNORD88C联合癌胚抗原CEA的AUC值分别为0.7097和0.7279。综上所述,SNORD88C在NSCLC中上调,可作为非侵入性诊断的biomarker。
In vitro功能研究表明,SNORD88C过表达和敲低分别促进和抑制肿瘤细胞克隆形成、细胞增殖、转移和侵袭;in vivo小鼠移植瘤实验发现,SNORD88C敲低会减小肿瘤体积和重量,促进肿瘤凋亡,抑制肿瘤转移。
为了探究SNORD88C调控的下游蛋白,作者进行了深入的机制研究。沉默SNORD88C后TMT蛋白组学发现,差异基因富集到了不饱和脂肪酸合成等代谢相关通路,GC-MS代谢组学发现,SNORD88C敲低后油酸OA(一种单链不饱和脂肪酸MUFA)显著下调, C11 bodipy探针检测证实沉默SNORD88C促进脂质过氧化,提示SNORD88C促进脂质积累和过氧化。由于代谢可调控肿瘤自噬,文章进而探究了SNORD88C对自噬的影响。荧光标记anti-LC3B定位及WB实验发现,SNORD88C促进mTOR/ULK1磷酸化,进而抑制自噬体形成。前期质谱结果揭示MUFA合成酶SCD1在沉默SNORD88C后下调,过表达SCD1可重新激活被SNORD88C沉默所抑制的自噬和mTOR,进而影响肿瘤转移侵袭。
为了探究SNORD88C调控SCN1的机制,文章通过snoPY数据库预测SNORD88C靶定28S rRNA,可以在其c3680位添加2'-O-me 修饰。Polysome profiling实验证明,SNORD88C沉默显著降低SCD1 mRNA在polysome和monosome组分的富集,进而在翻译水平调控SCD1表达。
技术路线

结果展示
1. 高通量筛选和验证
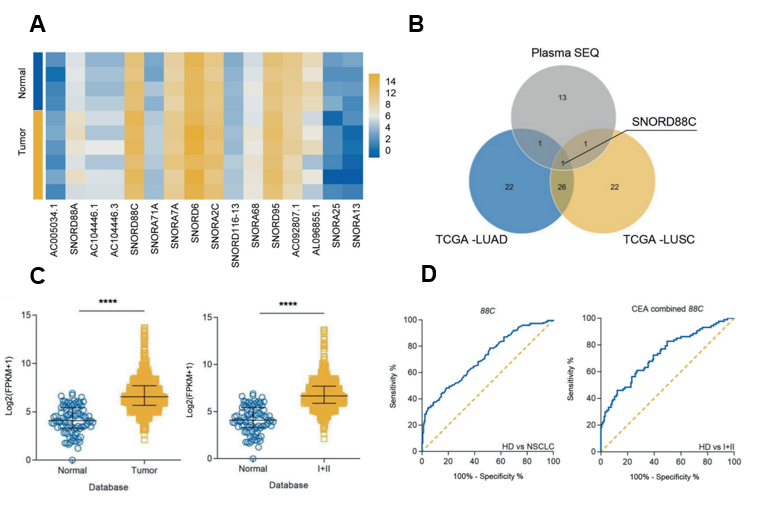
图1:NSCLC癌和癌旁组织\癌与正常血浆中的SNORD88C表达上调。
A SnoRNA测序结果的热图显示SNORD88C在NSCLC病人血浆中表达上调;
B TCGA SNORic数据库中LUAD和LUSC差异表达snoRNA与NSCLC血浆差异snoRNA取交集,获得疾病中共同上调的SNORD88C;
C 扩大样本TCGA组织验证SNORD88C在NSCLC疾病及疾病早期上调;
D ROC曲线分析SNORD88C可作为NSCLC和早期NSCLC biomarker。
2. 功能实验
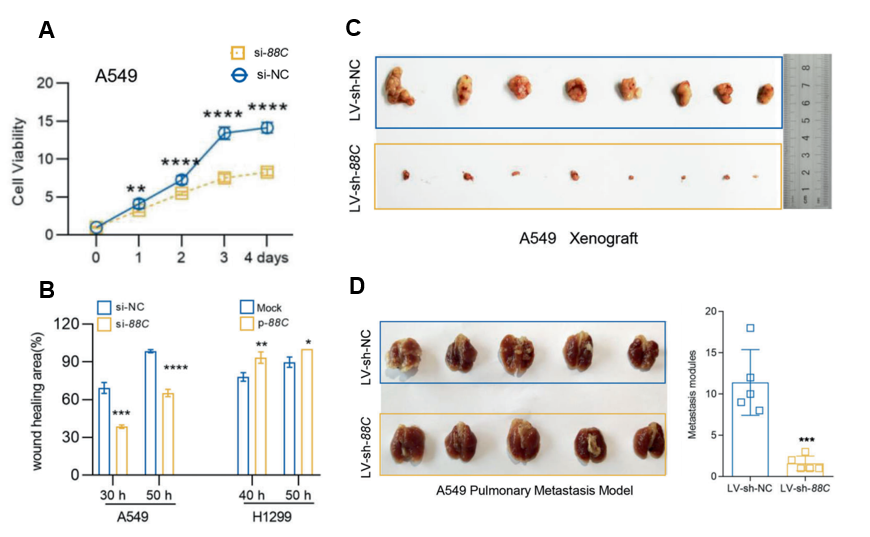
图2:功能研究证实SNORD88C的表达促进NSCLC肿瘤发生发展。
A-B In vitro实验证明敲低/过表达SNORD88C促进/抑制NSCLC细胞的增殖和迁移;
C-D In vivo实验小鼠移植瘤实验证明敲低SNORD88C抑制移植肿瘤生长和转移。
3. 功能机制实验
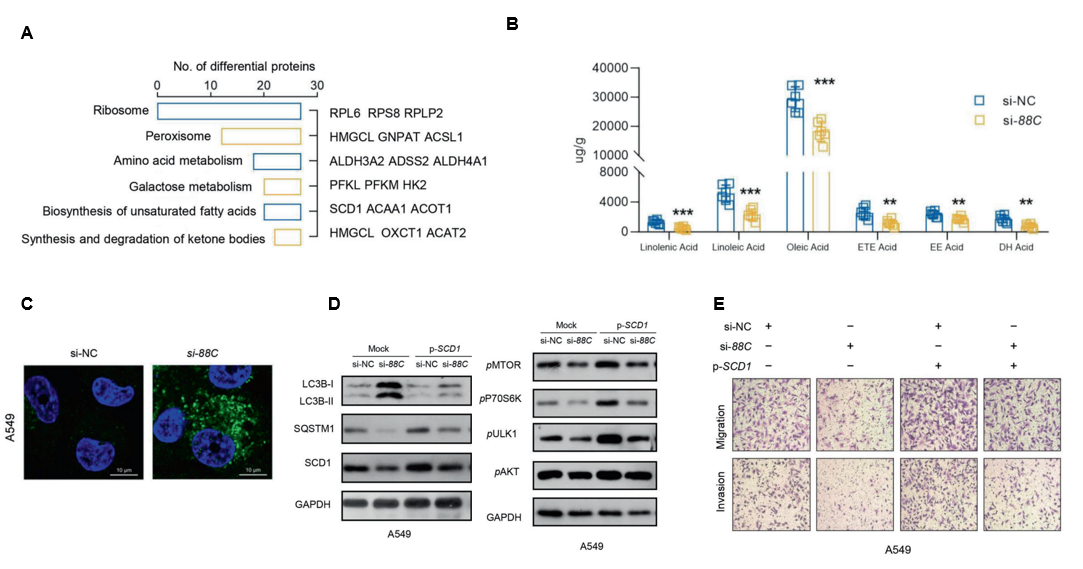
图3:功能机制研究,SNORD88C影响脂质积累和过氧化进而影响自噬和肿瘤转移侵袭。
A LC-MS TMT蛋白组学通路富集分析证实SNORD88C调控核糖体和代谢;
B GC-MS代谢组学验证siRNA干扰SNORD88C显著降低油酸等MUFA;
C 荧光标记anti-LC3B定位实验发现,SNORD88C抑制自噬体形成;
D WB实验发现,过表达SCD1可重新抑制被SNORD88C沉默所激活的自噬,并重新激活被SNORD88C沉默所抑制的mTOR/ULK1磷酸化;
E 过表达SCD1可重新激活被SNORD88C沉默所抑制的肿瘤转移侵袭。
4. 机制实验
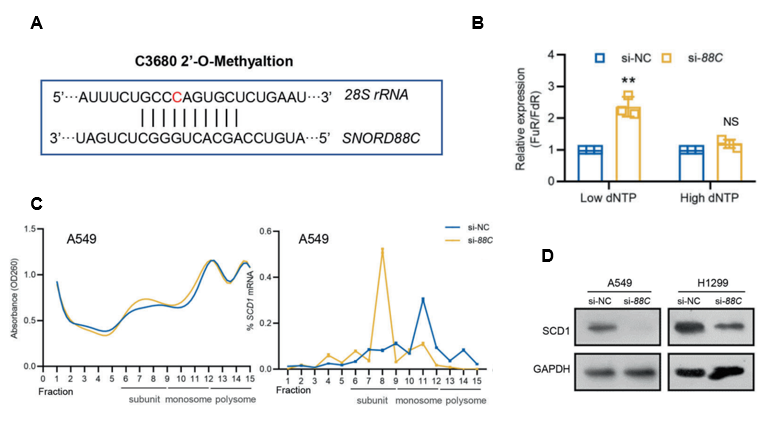
图4:机制研究,SNORD88C通过介导28S rRNA 2’-O-me修饰进而促进SCD1翻译。
A snoPY预测SNORD88C结合并促进28S rRNA 2’-O-me修饰;
B RTL-P实验证明SNORD88C敲除抑制28S rRNA 2’-O-me修饰;
C Polysome profiling及qPCR证明SNORD88C沉默显著降低SCD1 mRNA在polysome和monosome组分的富集;
D WB实验证明SNORD88C敲除抑制SCD1蛋白水平。
研究意义
本研究使用snoRNA测序筛选NSCLC病人血浆中差异的snoRNA,并与TCGA数据库病人组织样本中差异snoRNA取交集,发现SNORD88C在疾病及早期上调,可作为非侵入诊断的biomarker。In vivo和in vitro功能研究表明,SNORD88C可促进NSCLC的肿瘤生长,增殖、侵袭转移并抑制自噬。机制研究发现,SNORD88C可以促进28S rRNA C3680位的2’-O-甲基化修饰,进而促进rRNA的成熟,增强下游SCD1的翻译。SCD1是单不饱和脂肪酸MUFA的合成酶,通过调节脂质积累和过氧化来抑制自噬,并激活mTOR促进转移侵袭。该研究为SNORD88C调控NSCLC提供了新思路。。
原文出处
https://www.nature.com/articles/s41418-022-01087-9
康成生物丨数谱生物可提供的相关技术服务
snoRNA测序
snoRNA qRT-PCR

