

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
南京医科大学许林教授长期从事肺癌的临床和基础研究,肿瘤早期诊断分子标记物及分子致病机理的相关研究,近期该课题组发表了题为“Super-enhancer hijacking LINC01977 promotes malignancy of early-stage lung adenocarcinoma addicted to the canonical TGF-β/SMAD3 pathway”的研究性论文,该文章采用Arraystar超级增强子lncRNA芯片筛选发现LINC01977被超级增强子诱导大量表达,并通过调控TGF-β/SMAD3通路,促进肺腺癌的预后恶化。实验结果显示,linc01977在肺腺癌病人组织和细胞系中,表达量均明显上调。功能研究结果展示linc01977可增强肺腺癌细胞的增殖和迁移能力,敲低linc01977可显著抑制肺腺癌细胞体外增殖。机制研究发现,linc01977与SMAD3结合介导其在细胞核内的积累,激活SMAD3与CBP/P300的相互作用;同时在TGF-β的刺激下表观调控下游靶基因ZEB1,从而促进肿瘤迁移。该研究成果于2022年发表于学术期刊Journal of Hematology & Oncology,影响因子为23.168(Arraystar超级增强子lncRNA芯片由康成生物|数谱生物提供技术服务)。

研究背景
肺癌是世界上最常见的肿瘤类型之一,其中肺腺癌(Lung adenocarcinoma, LUAD)发病率在所有肺癌病例中占比高达40%。切除或联合辅助化疗/放疗的早期LUAD患者有许多会在5年内复发,导致预后恶化。尽管目前已在识别和治疗疾病复发的方法方面取得了长足的进步,但其分子机制仍未得到完整的阐明,因此,发现肺腺癌新的诊断标志物和治疗靶点、揭示导致疾病复发和预后恶化的机制依然极为重要。
超级增强子(super-enhancer, SE)是指具有增强子活性的基因组区域,它通过募集核心调节回路转录因子来介导人类癌症中的转录失调,SE还可产生增强子RNA(eRNA)或劫持启动子促进lncRNA的大量表达,这种lncRNA被称为超增强子相关lncRNA(SE-lncRNA)。据报道,TP63和SOX2通过激活其在鳞状细胞癌中的SE和启动子来协同调节lncRNA LINC01503的表达。受SE和TP63调控的LINC01503激活ERK和AKT通路,促进鳞状细胞癌的进展。然而,在LUAD中SE-lncRNA的功能仍然未知。
研究思路
文章着重于研究SE-lncRNA在肺腺癌中的主要功能和调控机制,作者运用Arraystar超级增强子lncRNA芯片检测5对LUAD癌和癌旁组织中SE-lncRNA的表达水平,采用差异倍数≥2,且P值<0.05筛选出尚未报道过的LINC01977分子,经过超级增强子marker H3K27Ac和H3K4me1 ChIP-Seq验证,LINC01977在肿瘤组织中的表达被SE显著增强,与预后不良密切相关,具有良好的诊断价值。
功能研究发现,在LUAD 细胞系A549中敲低LINC09177抑制细胞增殖,S期细胞减少,细胞自噬得到增强,迁移能力减弱,降低了细胞的克隆形成;裸鼠移植实验发现,抑制LINC01977使肿瘤与对照组相比体积更小、重量更轻且生长迟缓,表明LINC01977的高表达显著促进LUAD的恶性发展。
机制研究分离核质RNA、FISH等实验发现LINC01977定位于细胞核,RNA pulldown揭示LINC01977依赖MH2结构域与SMAD3蛋白结合,促进其在细胞核内的积累,并在TGF-β刺激下促进SMAD3和CBP/P300之间的相互作用,LINC01977通过参与SMAD3/CBP/P300复合物,促进ZEB1启动子H3K27Ac修饰,激活下游肿瘤转移的核心因子ZEB1转录, ZEB1的高表达促进了肿瘤细胞EMT转移过程。被SE劫持的LINC01977可以作为早期LUAD治疗的潜在靶点。
技术路线

结果展示
1. 高通量筛选
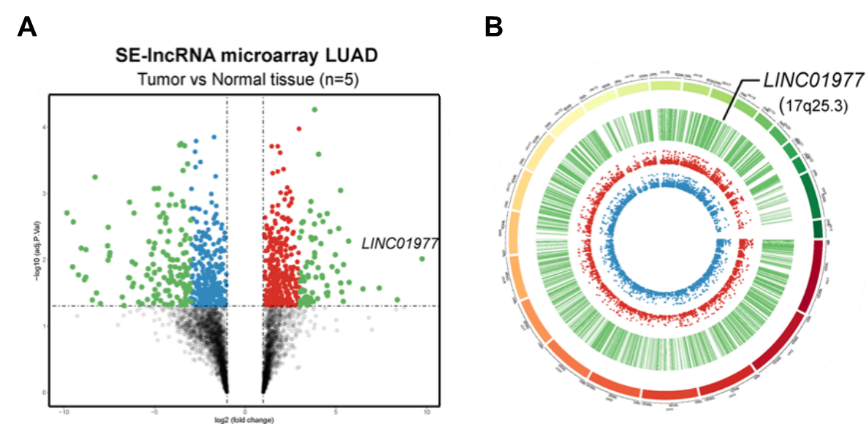
图1:LAUD癌和癌旁组织中的SE-lncRNA表达谱发生明显变化。
A Arraystar SE-lncRNA芯片结果的火山图显示LINC01977在癌组织表达上调;
B差异表达SE-lncRNA的circos图。
2. qPCR验证与临床应用
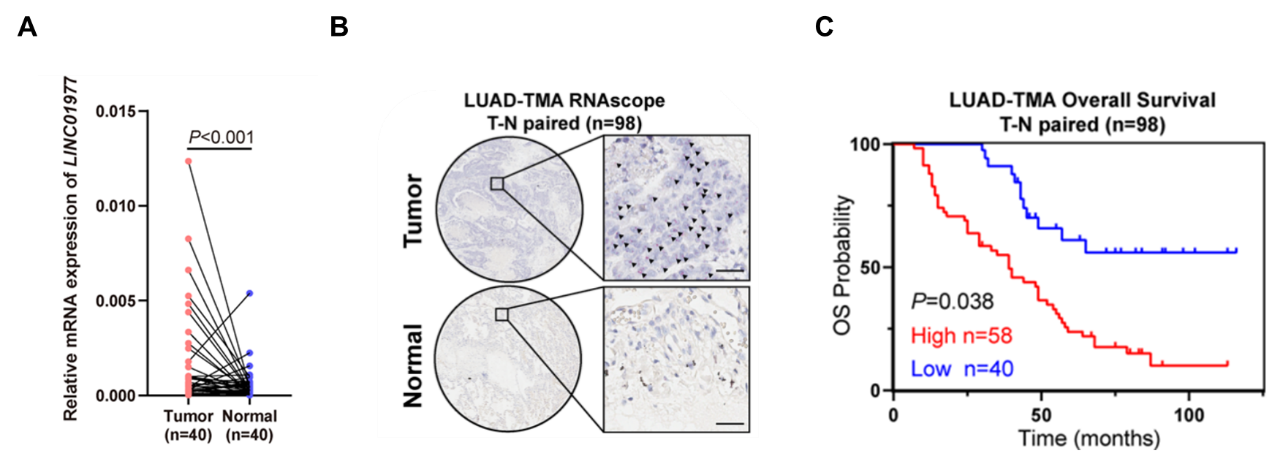
图2:LINC01977在LUAD组织中高表达的验证。
A LUAD癌vs.癌旁组织(n=40)qPCR验证LINC01977表达上调;
B LUAD癌vs.癌旁组织(n=98)RNA scope原位杂交检测LINC01977表达上调;
C KM分析表明LINC01977高表达与预后不良密切相关
3. 功能实验
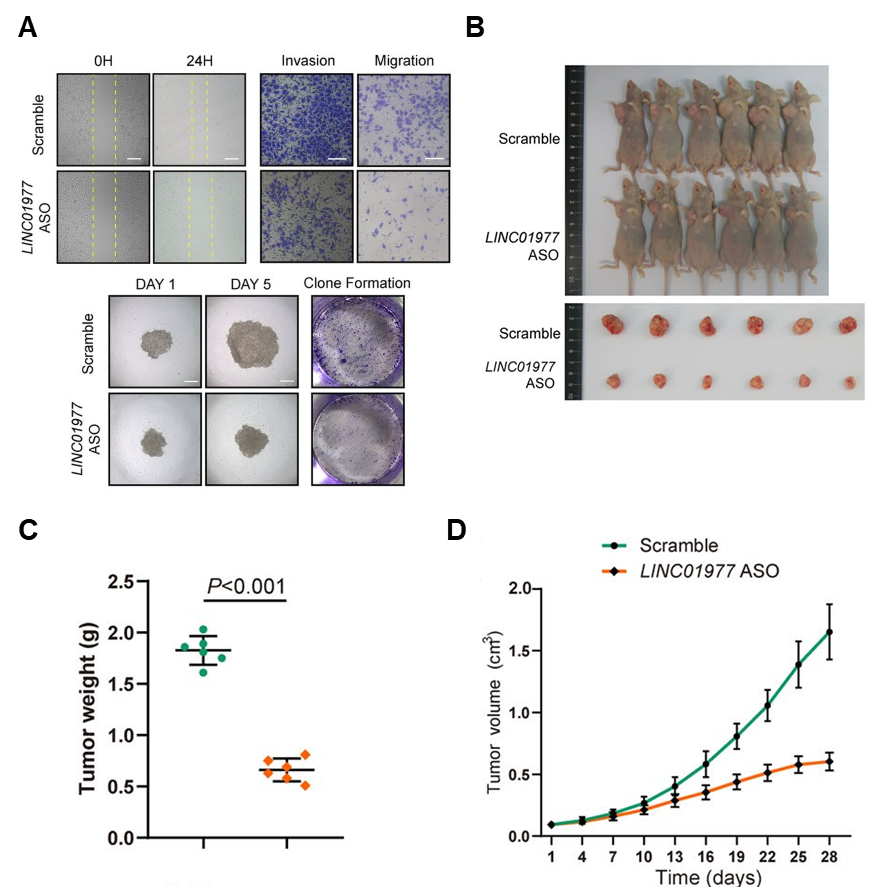
图3:功能研究证实LINC01977的表达促进LUAD肿瘤的恶性发展。
A In vitro实验证明敲低LINC01977减弱A549细胞的迁移(上图)和增殖能力(下图);
B-D In vivo实验证明敲低LINC01977抑制移植肿瘤发展(C, 肿瘤重量;D, 肿瘤体积)。
4. 机制实验
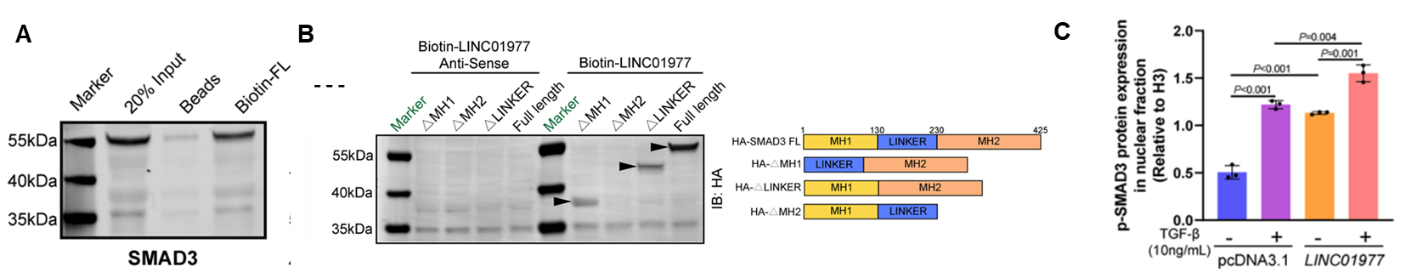
图4:机制研究1,LINC01977通过MH2结构域结合SMAD3。
A RNA pulldown-WB证实LINC01977可结合SMAD3;
B 不同HA标记SMAD3蛋白结构域验证LINC01977与SMAD3 MH2结构域相互作用;
C LINC01977介导SMAD3蛋白在细胞核中的积累。
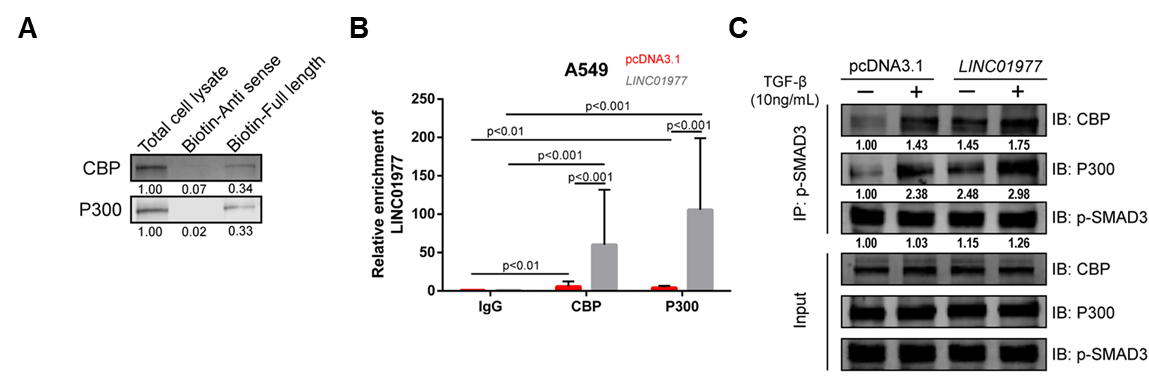
图5:机制研究2,LINC01977参与SAMD3/CBP/P300复合物的形成。
A RNA pull-down验证LINC01977和CBP/P300之间的相互作用;
B RIP和qRT-PCR验证LINC01977和CBP/P300之间的相互作用;
C TGF-β处理下LINC01977/SMAD3与CBP/P300的相互作用(Co-IP)。
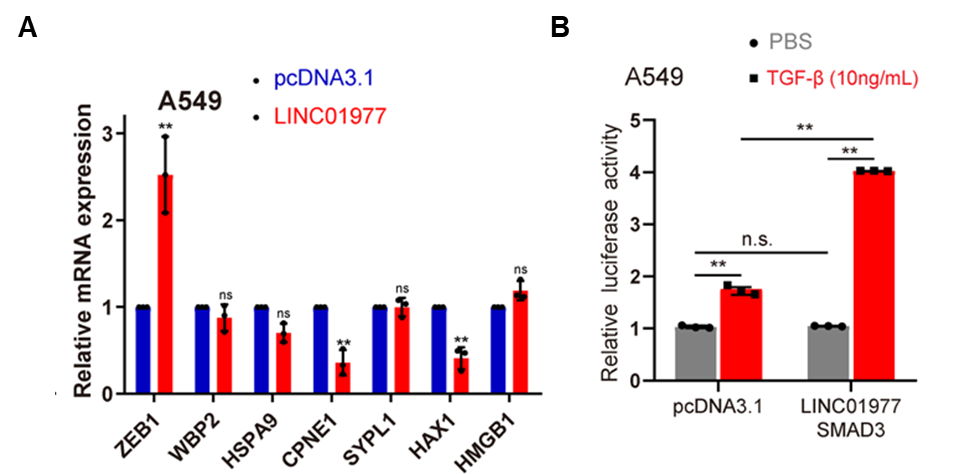
图6:机制研究3,LINC01977在TGF-β刺激下显著提高ZEB1表达水平。
A 过表达LINC01977促进ZEB1表达;
B 转染LINC01977和SMAD3后,ZEB1的转录活性在TGF-β处理的A549 细胞中显著升高。
5. 作用机制图
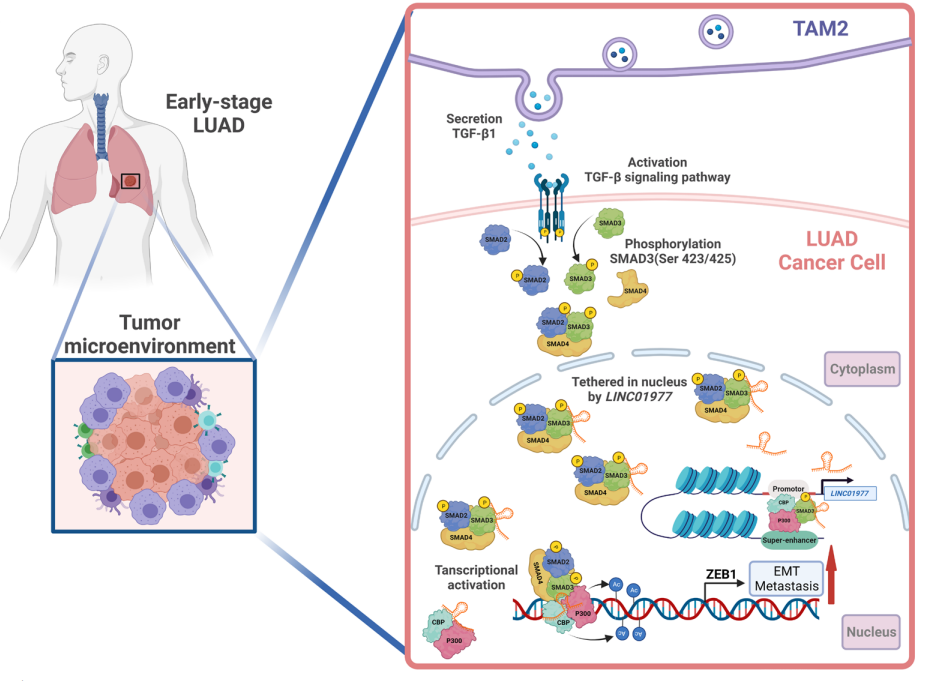
图7:作用机制图
肿瘤微环境中TAM2巨噬细胞激活LUAD肿瘤细胞TGF-β/smad3通路,促进LINC01977上调,LINC01977结合SMAD3并介导其核内积累,参与和促进SMAD3/CBP/P300复合物结合ZEB1并上调其表达,促进肿瘤EMT过程。
研究意义
本研究使用Arraystar SE-lncRNA芯片技术研究LUAD中差异表达的SE-lncRNA,并确定上调的LINC01977被SE劫持,促进体外和体内的肿瘤恶性表型发展,具有良好的病理诊断价值。LINC01977可促进肺腺癌细胞的增殖和迁移,并调控细胞周期和细胞自噬进程。文章讨论了LINC01977结合SMAD3并介导其核内积累,在TGF-β刺激下可参与和促进SMAD3/CBP/P300复合物的建立,并导致下游基因ZEB1的表观遗传激活。由于LINC01977高表达的LUAD患者在早期阶段生存期较短、预后较差,而SE-lncRNA作为早期 LUAD 的重要调控分子和治疗靶标具有良好的诊断和治疗潜力,为LUAD的治疗提供了新的思路。
原文出处
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-022-01331-2
康成生物丨数谱生物可提供的相关技术服务
RIP-PCR
CO-IP-MS
