

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 N-糖基化蛋白组学 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
microRNAs(miRNAs)是小的非编码RNA,长度为20-22bp,由基因组转录。microRNA通过和靶基因mRNA碱基配对引导沉默复合体(RISC)降解mRNA或抑制mRNA的翻译,从而在转录后水平调控蛋白表达(最新发现microRNA也能在转录水平调控基因表达)。microRNAs在物种进化中相当保守,在动物,植物和真菌等中发现的microRNAs表达均有严格的组织特异性和时序性。microRNA在细胞生长和发育过程中起多种作用,包括调控发育,分化,凋亡和增殖等。目前已公布的人microRNA(Sanger Institution于2007年8月发布的数据库资料)超过700个,是最初推算数目的3倍多,还有大量预测的microRNA基因需要通过实验验证。microRNA功能的普遍性和重要性直到最近几年,才逐渐被人们广为认识。
microRNA的产生和作用机理
microRNAs的生物合成需要复杂的蛋白系统,包括Argonaute家族成员,Pol II以及RNA酶III Drosha和Dicer 。microRNA基因在核内由RNA聚合酶II(pol II)转录,最初产物为具有帽子结构(7MGpppG)和多聚腺苷酸尾巴(AAAAA)的pri-microRNA。pri-microRNA在核酸酶Drosha和其辅助因子Pasha的作用下被处理成70个的pre-microRNA。pre-microRNA被RAN–GTP和exportin 5复合物输送到细质后,由核酸酶Dicer将其剪切为22个核苷酸长度的microRNA:microRNA*双链,并且很快被引导进入沉默复合体(RISC)中,其中成熟的microRNA保留,通过与其靶mRNA结合,调控基因表达。与靶mRNA不完全互补的microRNA通常结合在mRNA的3’端非翻译区,抑制蛋白质翻译(在哺乳动物中较普遍)。如果microRNA与靶位点完全互补(或者几乎完全互补),通常在mRNA的编码区,往往引起靶mRNA的降解(在植物中比较常见)。每个microRNA可以有多个靶基因,而几个microRNAs也可以共同调节同一靶基因,由此形成复杂的调控网络,精细调控功能基因的表达。
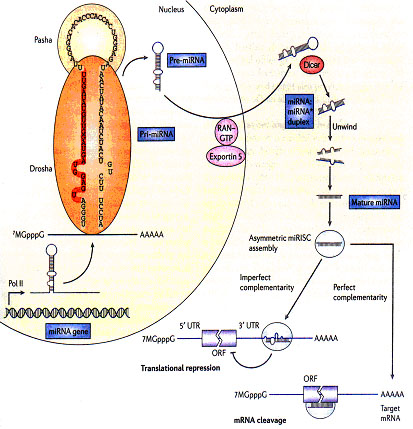
图1. microRNA的生物合成
microRNA在正常生理过程中的作用
目前,只有很小一部分microRNAs的生物学功能得到阐明。这些microRNAs调节细胞生长和组织分化,与生物生长发育有关。一系列的研究表明:microRNAs在细胞生长和凋亡,血细胞分化,同源异形盒基因调节,神经元的极性,胰岛素分泌,大脑形态形成,心脏发生,胚胎后期发育等过程中发挥重要作用。例如,miR-273参与线虫的神经系统发育过程;miR-430参与斑马鱼的大脑发育;miR-181控制哺乳动物造血细胞分化为B细胞;miR-375调节哺乳动物胰岛细胞发育和胰岛素分泌;miR-143在脂肪细胞分化起作用;miR-196参与了哺乳动物四肢形成,miR-1与心脏发育有关。另有研究人员发现许多神经系统的microRNAs在大脑皮层培养中受到时序调节,表明其可能控制着区域化的mRNA翻译。对于新的microRNA功能的分析,发现microRNA可能参与器官形成、胚胎发育和生长的调节因子,并促进对癌症等人类疾病发病机制的理解。
microRNAs与癌症
最先在B细胞慢性淋巴性白血病(CLL)中发现有microRNA表达水平的改变,随后陆续在各种人类肿瘤中均检测到microRNA表达水平的变化。研究发现,microRNAs与肿瘤形成相关,既能发挥肿瘤抑制基因的作用(如mir-15a和mir-16-1),也能起到癌基因的作用(如mir-155和mir-17-92簇)。因此,又将与癌症相关的microRNA命名为“oncomirs”。目前认为,在肿瘤细胞中,microRNA成熟体或前体表达水平异常,而表达异常的microRNA,通过影响靶mRNA翻译发挥作用,参与肿瘤形成过程,并起重要作用,如Ras原癌基因受let-7家族的调控,BCL2抗凋亡基因受miR-15a-miR-16-1簇调控,E2F1转录因子受miR-17-92簇调控,BCL6抗凋亡基因受miR-127的调控等。
表1. microRNA与肿瘤的临床研究
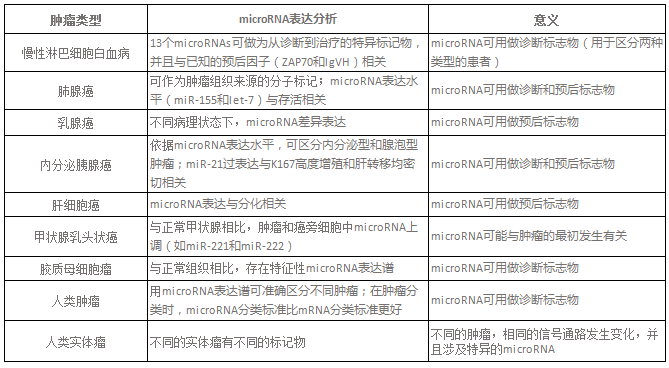
microRNA表达异常的原因
目前至少已经发现至少3种不同的机制(这些机制可能独立发挥作用,也可能协同作用),来解释为什么microRNA的表达会发生异常。
•microRNA定位在肿瘤相关基因组区域(CAGRs,cancer-associated genomicregions)
研究发现半数以上的microRNA定位于已经被证明的在肿瘤中会发生改变的染色体区域,包括:最小杂合子缺失区域(minimal regions of LOH),通常有抑癌基因定位其中;最小扩增区域(minimal regions of amplification),其中可能包含癌基因;常见的断裂位点(breakpoint regions),通常靠近癌基因或抑癌基因,以及脆性位点(FRA,fragile sites)。脆性位点是容易发生姐妹染色质交换,易位,缺失,扩增的位置,或者是质粒DNA和肿瘤相关病毒,如人乳头瘤病毒(HPV),插入的位点。microRNA位点与致癌性HPV(与子宫内膜癌相关)插入位置显著相关,据此推测,人类基因组中若有病毒的插入,也可能会干扰microRNA的功能。通过高分辨芯片兼容的基因组杂交(aCGH)方法发现,在肿瘤基因组中,microRNA位点变化的频率很高,约75%的成熟microRNA和DNA拷贝数之间存在相关性,这一结果与在乳腺癌中独立获得的表达谱数据一致,microRNA的扩增和过表达一致性达81%,microRNA缺失与表达下调一致性达60%。
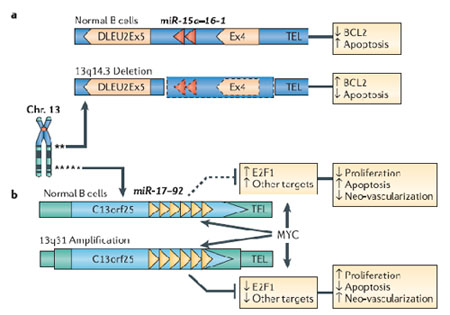
图2. 染色体水平上microRNA位点的改变
染色体水平上microRNA位点的两种主要改变,杂合子缺失和扩增,分别在13号染色体的两个独立区域被发现:
a 在13q14.3(microRNA簇,miR-15a-miR-16-1定位于其中)缺失的B细胞慢性淋巴细胞白血病中发现,miR-15a和miR-16-1表达下调,并引起抑制凋亡的BCL2蛋白水平上调。
b 在13q31(MicroRNA簇miR-17-92定位于其中)扩增的淋巴瘤中发现,来自同一个microRNA簇的miR-17-5p和miR-20a均发生表达上调,造成转录因子E2F1的表达下调。E2F1可以促进细胞增殖,但是当E2F1的表达水平超过一定阈值,也能引起细胞凋亡,因此,microRNAs对于E2F1的负调控作用,可能阻断E2F1诱导凋亡的功能,从而促进MYC介导的细胞增殖
•microRNA表达的表观遗传调控
细胞恶性转化的表观遗传标志包括DNA整体甲基化水平低,CpG岛过甲基化和组蛋白修饰失调等。研究发现,表观遗传改变同样会影响microRNA的表达。在乳腺癌细胞中,抑制组蛋白去乙酰化酶作用,会引起microRNA水平广泛而迅速的改变。用5-氮杂脱氧胞苷(5-AzaCdR)和组蛋白去乙酰化酶(HDAC)抑制物4-苯丁酸(PBA)联合作用于膀胱癌细胞,有17个microRNA(同时检测了313个microRNA)表达上调超过3倍,其中miR-127表达水平变化最大。而这个microRNA定位在染色体14q32的一个CpG小岛中,该区域在造血系统肿瘤中多发生易位,在实体瘤中会发生杂合子缺失(LOH)。此外,药物联合作用引起miR-127基因转录起始位点附近DNA甲基化水平降低和活性组蛋白标记增加。由于miR-127抑制BCL6的翻译,推测由5-AzaCdR和PBA联合作用于肿瘤细胞而诱导的miR-127表达,能抑制抗细胞凋亡因子如BCL6的表达,进一步诱导细胞凋亡,从而发挥抗癌作用。但是,对非小细胞肺癌(NSCLC)细胞进行去甲基化的处理或者结合HDAC抑制剂进行处理,microRNA表达水平没有显著变化;而且,在正常肺细胞中未发现miR-127的表达,在肺癌组织和正常肺组织中也没有表达差异。推测DNA去甲基化和组蛋白去乙酰化对microRNA表达的影响可能具有组织特异性
•与microRNA加工相关的基因及其蛋白的异常变化
microRNA生物合成所涉及的蛋白机制非常复杂,其中所涉及的蛋白若发生改变,对microRNA表达将有剧烈的影响。对NSCLC病人的大规模研究发现,在一部分肺癌病人中,Dicer蛋白下调,而Drosha蛋白的水平没有改变,并且,这一结果与NSCLC患者手术后存活率下降和肿瘤低分化状态存在相关性,而在NSCLC患者存活率与miR-155和let-7表达水平间也有相关性。由此,患者的生存率是microRNA异常加工和异常表达共同作用的结果。小RNA加工相关蛋白的遗传异常所带来的影响也大大超过预期。最近发现了一类新的种系特异性小ncRNAs(26-31个核苷酸),命名为PIWI-相互作用RNAs(piRNAs),它们能与睾丸特异性鼠PIWI蛋白直系同源物结合。尤为引人注意的是,人类的这一Argonaute蛋白亚类的同源蛋白,命名为HIWI,在染色体上定位于12q24.33,而这一区域与青少年和成年人的睾丸生殖细胞癌的发展密切相关。此外,HIWI在大多数睾丸精原细胞瘤中均为过表达。胃癌中HIWI的表达则与增殖的细胞相关。这些研究提示,piRNAs可能代表了在肿瘤中发生改变的小ncRNAs的另一种类型,即与PIWI过表达相关。
microRNA研究的临床意义
•microRNA用于肿瘤诊断
在肿瘤诊断中,存在原发瘤位置未知的转移瘤(CUP),表现为肿瘤转移(即癌症晚期),但是未发现原发瘤(即肿瘤最初发生的位置和转移起点)。在对这种分化差和没有明显的组织学诊断特征的肿瘤进行诊断分析时,发现基于microRNA的分类方法比基于mRNA的分类方法更为准确。因为相较需要分析成千上万的mRNA的方法,现在只需分析几百种microRNAs即能有效的进行CUP诊断。对在西方社会最常见的成人白血病之一,CLL,也通过microRNA表达谱分析找到了可做为特异性标记物的microRNAs,可以按照预测的预后效果好坏或者疾病是否会恶化对病人进行区分。此前只有极少的预后标记物,如70kDa的zeta链相关蛋白(ZAP70)和免疫球蛋白重链可变区基因(IgVH)等被发现。例如,预后好的CLL病人,miR-16-1和miR-15a表达水平低,与此前的发现,预后好的CLL病人存在基因组13q14.3位点缺失一致,并且缺失的部分正包括miR-16-1和miR-15a。在预后差的CLL病人中,则发现了表达下调的miR-29家族。最近发现,在恶性期病人CLL细胞中过表达的癌基因TCL1,正是miR-29的靶基因之一。据此推测,可能存在两种不同分子类型的CLL,其临床特征相反:一种是染色体13q14.3缺失,miR-16-1和miR-15a低表达型,病人预后良好,疾病进展缓慢;另一种是miR-29基因低表达,TCL1蛋白高表达型,疾病进展为恶性期,并且出现Richter综合症。
•microRNA用于预后分析
对全世界的男性癌症患者来说,死亡率最高的是肺癌。新的预后标志物(即与疾病进展相关的标记)可以提高诊断的效果。通过对美国肺癌患者的单变量分析,发现miR-155(高表达)和let-7a-2(低表达)的水平与病人的存活率差相关;多变量分析同样发现,即使考察了所有临床变量,miR-155的表达水平仍然与预后差相关。在对143位日本肺癌病人的独立研究中,发现let-7表达水平下降与外科治疗后生存时间缩短显著相关。在多变量分析中,let-7低表达可以作为独立的预后标志用于疾病分期,并且与生存期缩短显著相关。综合29项Ras癌基因在NSCLC癌症病人存活中作用的研究,并进行荟萃分析,发现Ras过表达与生存期缩短有关,由于let-7对 Ras有负调控作用,更支持了let-7,Ras表达和肺癌病人预后间的相关性。
•microRNA用于肿瘤治疗
microRNAs是天然的反义作用因子,能够调控与真核生物生存和增殖相关的多种基因。在肿瘤治疗方面,microRNA的前景光明。在利用microRNA作为治疗靶点方面,已有实验支持:如用吉西他滨(gemcitabine)治疗的过程中,出现microRNA表达谱的变化;调控部分microRNA的表达水平(如使miR-21过表达),能增进胆管癌细胞对化疗药物的敏感性。而发展能应用在体内,半衰期更长,功效更久,经过改造的microRNA分子,例如LNA修饰的寡核苷酸,抗microRNA寡核苷酸(AMOs)和反义microRNA(antagomirs)等,是基础研究成果向临床治疗转化的起始步骤。未来,还需要进行体内的microRNA转基因和敲除试验,为microRNA治疗的安全性和有效性提供有用信息。
结论和展望
microRNA在细胞分化,生物发育及疾病发生发展过程中发挥巨大作用,对于microRNA的研究也在不断展开和深入。随着对于microRNA作用机理的阐明,以及利用如microRNA芯片等高通量的技术手段对于microRNA和疾病之间的关系进行研究,将会使人们对于高等真核生物基因表达调控的网络理解提高到一个新的水平。microRNA是疾病诊断的新的生物学标记,还可能进一步成为分子药靶,或是模拟其作用机制进行新药研发,为人类疾病,如肿瘤的治疗提供新的思路和手段。

