

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
蛋白修饰定量 乳酸化修饰蛋白质组学 O-GlcNAc修饰蛋白质组学 |
中国工程院院士、第二军医大学王红阳教授课题组长期从事恶性肿瘤的基础与临床研究,对肿瘤发生发展的分子病理机制和细胞信号转导有重要建树。近期,该实验室使用Arraystar LncRNA芯片发现了与肝癌干细胞的自我更新相关的分子--Lnc-DILC。高表达的Lnc-DILC可以竞争性结合IL-6,阻碍NF-KB /IL-6复合物形成,影响下游STAT3的表达,使肝癌干细胞自我更新受阻。该研究成果发表在Journal of hepatology (IF:10.59)。(芯片实验由康成提供技术服务)
研究背景
肝癌(HCC)是全球范围内最常见的恶性肿瘤之一,肝部切除手术是治疗肝癌首选方法,术后复发率高是造成患者预后不良的主要原因。癌症的复发可能跟具有自我更新、自我保护、抗凋亡等特点的癌症干细胞相关。研究肝癌干细胞(LCSCs)被认为是了解肝癌侵袭转移的途径之一。LncRNA是一类长度超过200nt的非编码RNA分子。许多研究证明LncRNA可以与癌症相关基因相互作用,在多种肿瘤的发展进程中发挥重要功能。LCSCs中lncRNA的相关研究报道目前比较少,该篇文章的研究预示着Lnc-DILC不仅可以作为肝癌预后标志物,也有作为治疗靶点的可能。
研究思路
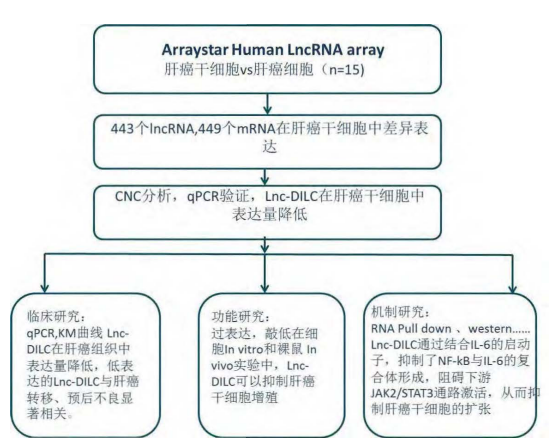
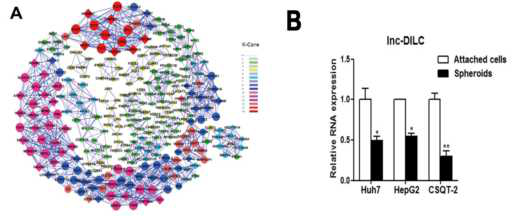
文章使用三种肝癌细胞系(Huh7, HepG2, CSQT-2)进行肝癌干细胞(LCSCs)培养,通过美国Arraystar Human LncRNA芯片筛选肝癌细胞(HCC)和LCSCs,获得差异表达的443个LncRNA,449个mRNA。在三组细胞系中,LncRNA-DILC在LCSCs中表达均下调,qRCR验证结果与芯片相符。共表达分析(CNC)发现LncRNA-DILC与多个基因相互作用,qRCR验证其表达与肝癌干细胞标志物-EpCAM/CD24的表达负相关。确认LncRNA-DILC为后续研究对象,通过RACE确认序列信息。
为了进一步研究LncRNA-DILC在LCSCs自我更新中的作用,构建过表达和敲低LncRNA-DILC的肝癌细胞进行LCSCs培养,发现敲低LncRNA-DILC的肝癌细胞中检测到的EpCAM/CD24表达量和多能性相关转录因子(如Oct-4)的表达量均高于过表达组,且形成LCSCs数量多,增殖快。将敲低和过表达的LncRNA-DILC的LCSCs注射裸鼠皮下组织成瘤,观察到高表达的LncRNA-DILC显著抑制了移植瘤的体积,说明其在LCSCs形成的癌扩散中起作用。
作者通过PCR Array 筛选到一些在肝癌干细胞中高表达的信号通路,Western验证LncRNA-DILC可以与JAK2/STAT3通路互作。对肝癌干细胞进行qPCR验证,药物处理实验,发现LncRNA-DILC抑制STAT3表达,影响STAT3入核,并降低了LCSCs的耐药性。癌干细胞中IL-6可以激活JAK2/STAT3的表达,该实验也观察到IL-6与LncRNA-DILC的表达呈负相关。序列分析,得到LncRNA-DILC能与IL-6启动子序列互补配对。RNA pull down验证二者结合,设计与IL-6相同序列,转染过表达LncRNA-DILC的LCSCs,发现其对IL-6的抑制作用消失,而过表达突变的结合序列没有该效果。进一步,作者检测了NF-kB与IL-6的结合受过表达的LncRNA-DILC的抑制,从而,揭示了LCSCs中LncRNA-DILC的分子作用机理。
临床应用方面,作者对195例肝癌患者癌和癌旁组织LncRNA-DILC的表达进行研究,LncRNA-DILC在癌症样本中表达量低,与肝癌干细胞特异膜蛋白EpCAM/CD24含量负相关。对肝癌病人的预后效果具有很好的指示作用,可以作为预后标志物。
技术路线
结果展示
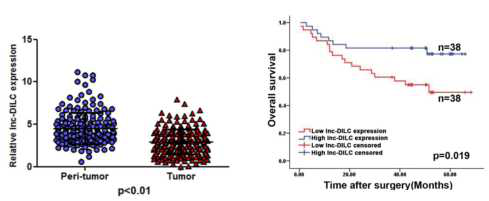
图二、左图临床样本验证,LncRNA-DILC在肝癌组织中表达显著低于癌旁组织 右图 KM曲线显示LncRNA-DILC的表达与预后效果显著相关,LncRNA-DILC的表达降低预后效果差。
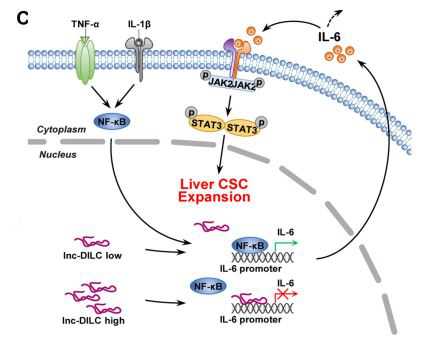
图三、LncRNA-DILC在肝癌干细胞扩增中的作用机制示意图
研究意义
作者介绍
原文出处

