

|
单细胞测序技术服务 靶向lncRNA单细胞全转录组测序 单细胞全转录组测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 CoIP-MS/AP-MS |
|
NGS测序技术服务 DRIPc-seq |
|
NGS测序技术服务 环状DNA测序 |
|
基因芯片技术服务 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表观转录组学测序服务 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
NGS测序技术服务 DNA(羟)甲基化测序(抗体法) DNA甲酰基胞嘧啶(5fc)修饰测序 DNA 5hmC 测序(化学法) 染色质免疫共沉淀测序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
|
Ribo-seq Ribo seq |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
四川大学卫生与环境卫生学系张遵真教授长期从事环境污染物诱发癌症的相关研究,课题组采用Arraystar mRNA&lncRNA表观转录组芯片筛选发现RNA m6A修饰动态调控AKT1的表达和活性,促进砷致皮肤癌在不同阶段的恶性增殖。实验结果显示,关键的癌细胞增殖信号节点AKT1蛋白在砷致癌过程中位于m6A调控网络的中心。该研究成果于2022年发表在学术期刊Journal of Hazardous Materials上,影响因子为14.224(Arraystar mRNA&lncRNA表观转录组芯片由康成生物|数谱生物提供技术服务)。

研究背景
无机砷是一种广泛存在的环境污染物,已被国际癌症研究机构确定为最具危害性的人类致癌物,慢性砷中毒是导致皮肤癌发生的主要原因之一,其致癌机制研究是世界关注的热点。表观遗传修饰作为细胞快速响应环境变化的重要机制,在砷致癌作用中扮演了至关重要的角色。RNA分子中腺苷第六位N原子的甲基化修饰(m6A)是最常见和最引人注目的RNA表观遗传修饰类型,最近已被发现m6A修饰可通过影响底物RNA的命运来加速皮肤癌的发展。因此,寻找m6A在砷致皮肤癌变中的核心靶基因,阐明m6A对靶基因的调控机制,可以极大地推进对有害物质致癌分子机制的理解和潜在治疗靶点的发现。
研究思路
文章着重于研究m6A修饰对砷致皮肤癌在恶性增殖的不同阶段AKT1表达和活性的动态调控机制,作者运用Arraystar mRNA&lncRNA表观转录组芯片技术检测了砷处理的细胞和对照细胞的RNA m6A修饰模式,采用差异倍数≥1.5,且P值<0.05筛选出1330个在砷处理的细胞中较对照细胞具有更高m6A水平的mRNA分子。通过与GSE110852数据集的RNA表达分析取交集,作者在其中筛选出55个基因在暴露于高低水平砷的受试者之间存在显著表达差异,而这些基因共同形成了一个以AKT1为中心的相互作用网络,表明关键信号节点AKT1可能是调节砷致癌发生和增殖相关过程的主要因子。在砷致癌细胞模型中,随着m6A水平的升高,AKT1表现出显著的表达上调,表明AKT1表达和功能与m6A修饰情况密切相关,具有潜在的临床价值。
功能研究发现,抑制m6A writer METTL3活性或降低表达后,砷致癌细胞的增殖和存活受到抑制,细胞总m6A修饰、AKT1 mRNA、蛋白质表达降低,而且通过MeRIP-PCR发现AKT1 mRNA特定区域(3'-UTR、CDS和5'-UTR)的m6A水平降低;而抑制m6A eraser FTO使AKT1 mRNA m6A水平提高,但只在早期(砷处理8周)增强了砷致癌细胞的增殖和存活能力,同时使AKT1 mRNA和蛋白质表达增加,对中期细胞 (砷处理22周)没有影响,在晚期则抑制了其生存(砷处理34周),并使AKT1 mRNA和蛋白质表达降低。表明m6A修饰在砷致癌的不同阶段对AKT1的表达和功能发挥重要作用。
机制研究发现,通过MeRIP-qPCR和Co-IP可以检测到不同的m6A reader在砷致癌不同阶段结合AKT1 mRNA及其蛋白质,并与相应的writer/eraser组合产生复杂的相互作用,YTHDF1促进砷致癌细胞的增殖和存活,YTHDF2则抑制砷致癌细胞的生存。在早期砷致癌细胞中,AKT1 mRNA的m6A水平被METTL3介导增加并通过结合m6A reader YTHDF1促进其表达;在砷致癌晚期细胞中,AKT1 mRNA的m6A修饰被FTO介导降解,减少了与m6A reader YTHDF2结合,保证了AKT1的持续表达和癌细胞的存活。另外,m6A水平的升高还将诱导下游因子mTOR、PHLPP2和PDK1的差异化表达、上调AKT1蛋白的磷酸化水平,从而引发癌变。
技术路线

结果展示
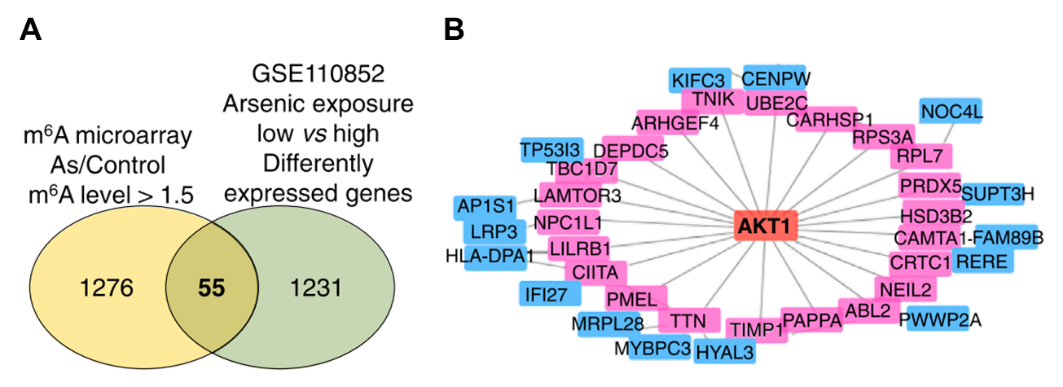
图1:AKT1是砷致癌作用中m6A调控网络的核心。
A Arraystar表观转录芯片差异m6A修饰基因与高砷vs.低砷暴露受试者差异表达基因有55个交集;
B相互作用网络显示A中交集基因的共同调节因子AKT1。
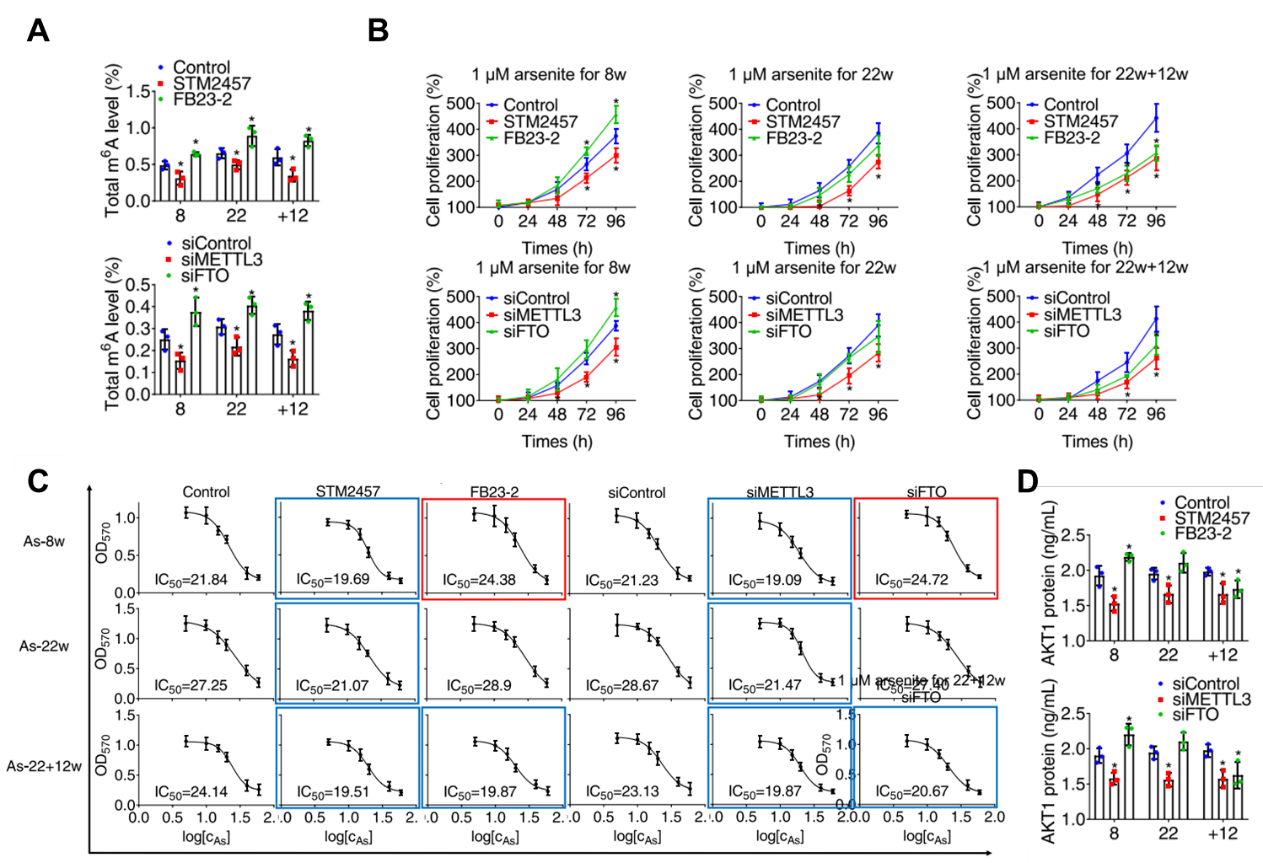
图2:功能研究,验证砷致癌细胞模型中m6A水平对细胞癌变的影响。
A抑制m6A writer Mettl3/eraser FTO使m6A整体修饰水平降低或升高;
B m6A修饰水平升高或降低影响砷致癌模型细胞的增殖能力;
C m6A修饰水平升高或降低影响砷致癌模型细胞的存活能力;
D抑制m6A writer Mettl3/eraser FTO使AKT1表达水平降低或升高。
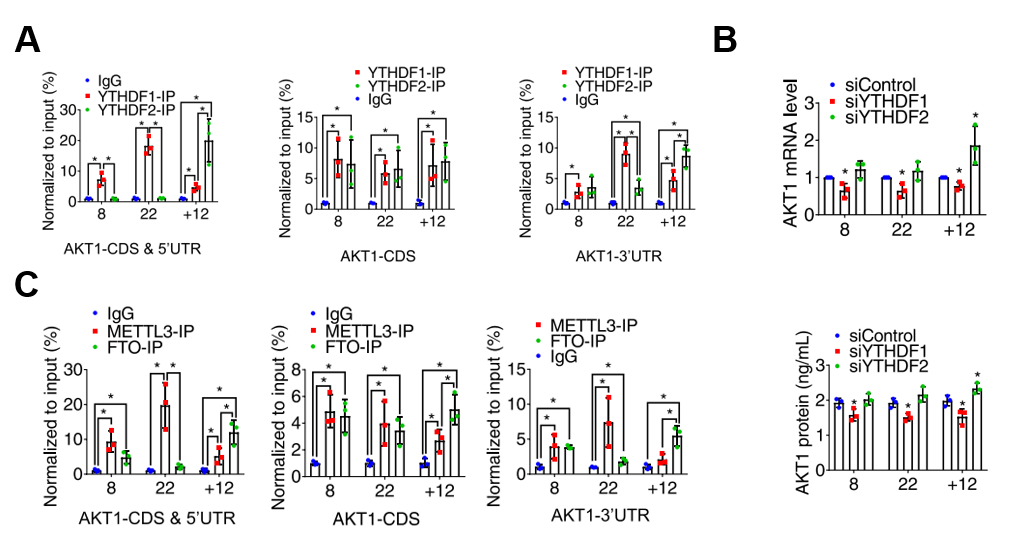
图3:机制研究1 Mettl3/FTO/YTHDF1/YTHDF2在砷致癌不同阶段结合AKT1 mRNA并调控其mRNA和蛋白水平。
A RIP-qPCR实验验证YTHDF1/2与AKT1 mRNA的结合能力;
B mRNA qPCR实验验证YTHDF1/2敲除影响AKT1 mRNA和蛋白水平;
C RIP-qPCR实验验证METTL3/FTO与AKT1 mRNA的结合能力。
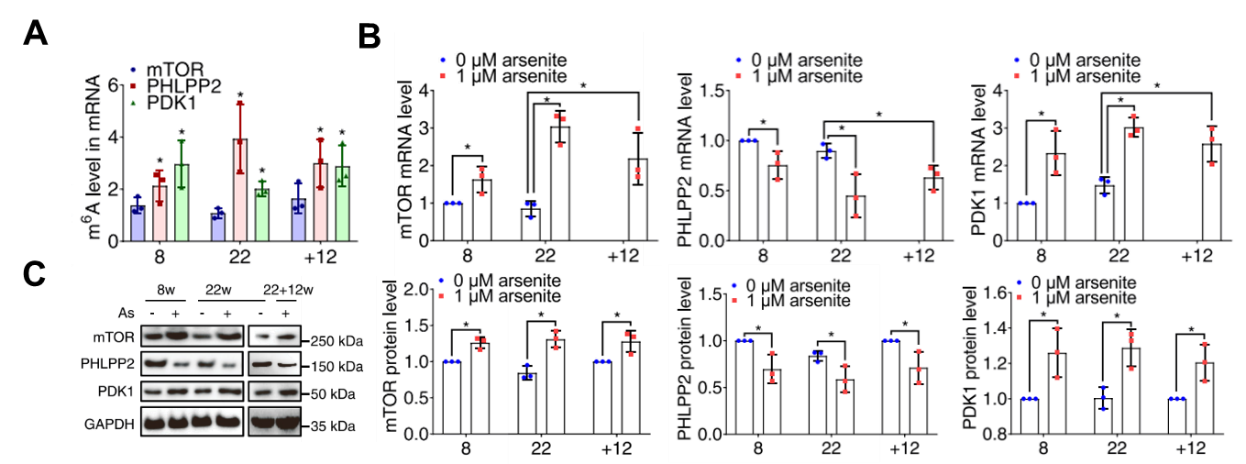
图4:机制研究2 砷处理对mTOR、PHLPP2和PDK1的影响。
A 砷处理影响mTOR、PHLPP2和PDK1 mRNA m6A修饰水平;
B 砷处理影响mTOR、PHLPP2和PDK1 mRNA水平;
C砷处理影响mTOR、PHLPP2和PDK1蛋白质表达水平。
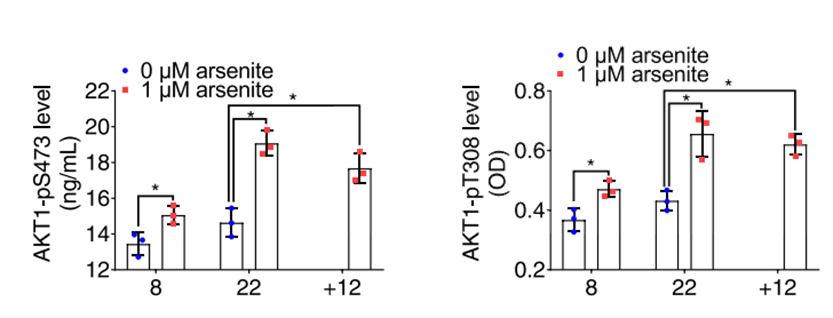
图5:机制研究3 砷处理最终激活AKT1蛋白S473和T308位点的磷酸化。
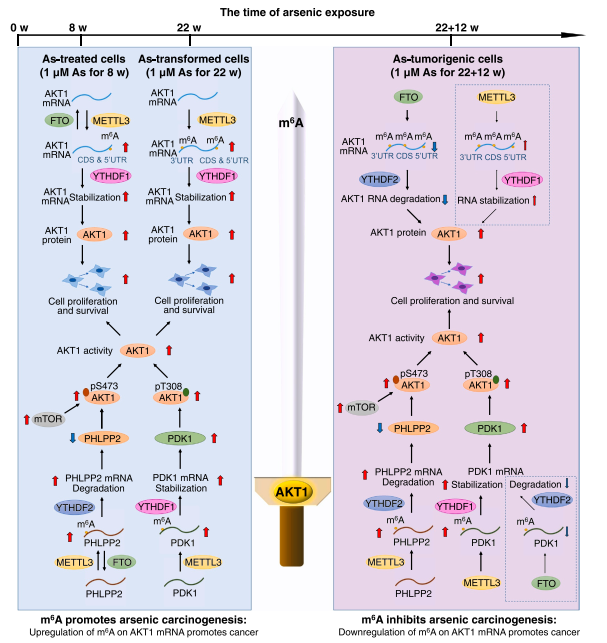
图6:作用机制图。
在砷致癌早期, AKT1 mRNA的m6A修饰由METTL3介导增加,并通过结合YTHDF1稳定自身的高水平表达,而在晚期癌细胞中,AKT1 mRNA上的m6A 又被FTO催化降解,以免被YTHDF2结合介导mRNA降解,从而维持自身的表达,而其他的调控因子PDK1和PHLPP2 mRNA上的m6A修饰也拥有相似的动态变化模式,最终被抑制的PHLPP2和被激活的PDK1共同磷酸化高表达的AKT1,从而引发了癌变进程。
研究意义
本研究使用Arraystar mRNA&lncRNA表观转录组芯片探索在砷致皮肤癌细胞模型中的RNA m6A修饰差异情况,发现AKT1 mRNA的m6A水平在砷致癌作用的不同阶段发生的动态变化,m6A修饰在调节核心靶基因AKT1方面在时间上呈现高度程序化的调节模式,可作为砷致癌作用中RNA表观遗传机制的时间标尺,对砷致皮肤癌的早期诊断具有良好的病理价值。文章不仅仅讨论了AKT1 mRNA的m6A修饰对砷致皮肤癌不同发展时期的影响,也深入探讨了m6A修饰通过在不同时期结合不同的m6A reader和相应的writer或eraser,保证自身的持续高水平表达,推动了表观遗传学修饰在癌症发展中的“双刃剑”功能的理解。且AKT1 mRNA的m6A修饰情况能作为良好的体内治疗靶点,为砷致皮肤癌的治疗提供了新的思路。
原文出处
https://www.sciencedirect.com/science/article/pii/S0304389422022622?via%3Dihub#sec0070
康成生物丨数谱生物可提供的相关技术服务
RIP-PCR

