

|
单细胞测序技术服务 靶向单细胞测序(lncRNA&mRNA) 单细胞测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
NGS测序技术服务 G4 Cut&Tag(DNA G4) G-loop检测 (G4&R-loop Cut&Tag) R-loop 测序(DRIPc-seq) |
基因芯片技术服务 RNA G-四联体 (rG4)芯片 |
|
NGS测序技术服务 环状DNA测序(eccDNA测序) |
|
Ribo-seq Ribo seq(ribosome profiling) |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC-seq |
|
蛋白表达定量 DIA定量蛋白质组学 Label free非标定量 TMT标记定量 PRM靶向定量 |
中山大学孙逸仙纪念医院院长、中科科学院院士宋尔卫教授团队长期从事RNA干扰在疾病中治疗应用及乳腺癌等恶性肿瘤相关研究。其研究团队利用Arraystar Human LncRNA芯片发现lncRNA NKILA可与NF-κB互作抑制其激活从而调控T细胞的激活诱导细胞凋亡(AICD)敏感性,进而影响肿瘤的免疫逃逸。NKILA上游受到TCR激活的钙离子流影响,进而影响钙调素及STAT1与NKILA启动子的结合最终促进NKILA的转录。相关研究成果发表在国际著名学术期刊Nature immunology(IF=21.809)杂志上(芯片实验由康成生物提供技术服务)。
研究背景
抗肿瘤特异性的细胞毒性T淋巴细胞(CTLs)在免疫清除过程中可以杀伤肿瘤细胞,尽管如此,癌症可以利用T细胞的激活诱导细胞凋亡(AICD)进行免疫逃逸。肿瘤微环境中的FasL、TRAIL和TNF等凋亡因子可诱导肿瘤浸润T细胞的AICD过程。由于不同的T细胞亚群在抗肿瘤过程中有不同的角色(CTLs和Th1抗癌,Th2和Treg促癌),他们对于肿瘤介导的AICD的敏感性以及他们的AICD对肿瘤免疫逃逸的贡献程度有待进一步的深入探讨。
lncRNA是一类具有表达调控功能的RNA分子,lncRNA在肿瘤浸润T细胞相关的肿瘤免疫调控过程中的功能未知,本研究目的是探究lncRNA对肿瘤浸润T细胞亚群的AICD敏感性的调控及在肿瘤免疫逃逸过程中的作用。
技术路线

研究思路
首先,作者通过研究发现肿瘤浸润T细胞不同亚群对AICD的敏感性不同。肿瘤微环境中,CD8+ T细胞活化分化的CTLs和CD4+T细胞活化分化的Th1凋亡敏感性高,免疫抑制型的Th2和Treg细胞凋亡敏感性低。将肿瘤细胞裂解物致敏的树突状细胞(Dendritic Cell,DC抗原提呈细胞)与T细胞共培养可活化T细胞形成CTLs杀伤肿瘤细胞,这些CTLs包括AICD敏感型和耐受型,其中NF-κB在AICD耐受型里面表达上调,(抗原刺激激活T细胞受体TCR,进而激活IκB激酶IKK,导致IκB磷酸化、泛素化降解,将NF-κB的P50/P65二聚体从NF-κB/IκBα复合物释放并入核启动靶基因转录)NF-κB灭活可以提高T细胞的AICD敏感性。
为了研究lncRNA在NF-κB调控AICD的过程中的关联性,作者利用Arraystar Human LncRNA 芯片对肿瘤细胞裂解物致敏的DC细胞共培养6天后激活的乳腺癌浸润T细胞样本分别做了IκBα和NF-κB组分P65抗体的RIP-Chip,鉴定到96个两种蛋白共同结合的lncRNA,作者同时利用Arraystar Human LncRNA芯片对未激活与6天后培养激活的T细胞进行差异表达lncRNA筛选,发现96个结合的lncRNA中有4个(XLOC_011899, RP11-854K16.3, RP11-315I20.3和NKILA)也发生了显著表达上调,作者利用qRT-PCR进行的lncRNA表达验证,RIP-qPCR进行了IκBα和P65结合lncRNA验证,与前期筛选趋势相符。
作者利用NKILA RNA pull down实验反向验证NKILA在CTLs中可以特异性富集IκBα、P65和P50,FISH定位实验证明NKILA、IκBα和P65可以共定位于细胞质中,这些实验提示NKILA可能结合P65对NF-κB-IκBα复合物进行调控。作者也研究了NKILA所受到的上游调控因素,通过ChIP、Luciferase实验发现受抗原刺激的TCR可以激活钙离子流促进钙调素入核并去除NKILA启动子的HDAC(组蛋白去乙酰化酶),进而促进组蛋白乙酰化及STAT1的结合,最终促进NKILA的转录。
随后,作者对NKILA进行了in vitro细胞水平的功能研究,用PHA培养激活T细胞扩增,再用anti-CD3诱导凋亡,NKILA shRNA干扰后凋亡被抑制,且IκBa磷酸化水平升高,NF-κB上调;利用NF-κB inhibitor JSH/sc-3060处理NKILA shRNA干扰后的T细胞,凋亡增加;NKILA shRNA也能抑制抗肿瘤特异性的CTLs被anti-CD3诱导的AICD过程。In vivo小鼠实验证明,利用乳腺癌病人来源的癌细胞构建移植瘤模型,NKILA敲除可以抑制T细胞的AICD过程并提高过继性细胞疗法的效果;CTLs进行NKILA敲除可以促进肿瘤细胞凋亡并且抑制肿瘤体积增长。
最后,作者进行了临床应用研究,在24个乳腺癌病人来源的外周血和肿瘤组织中分离不同T细胞亚群,发现NKILA在肿瘤特异性CTLs和Th1细胞中表达显著高于Th2和Treg细胞;对206个乳腺癌病人进行生存分析发现,NKILA高表达的肿瘤特异性CTLs含量高的病人预后生存期降低,说明NKILA与临床预后有相关性。
结果展示
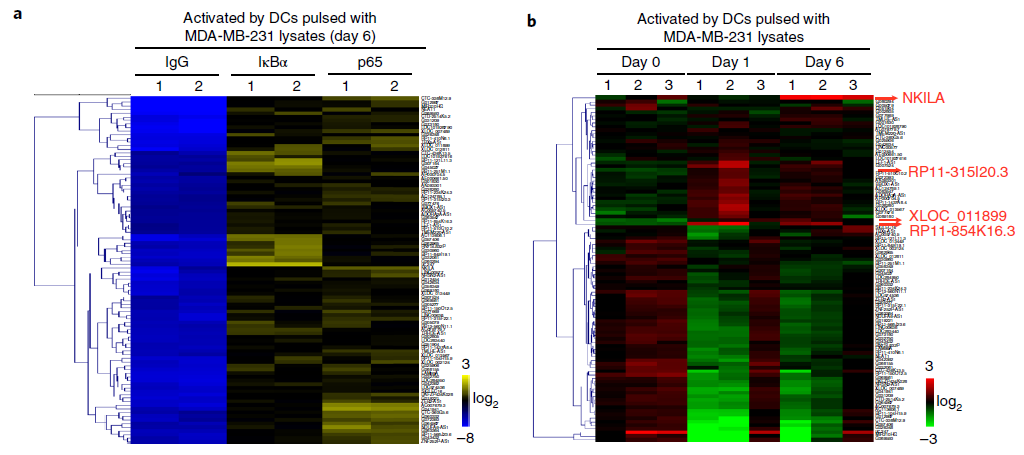
图1 Arraystar Human lncRNA芯片筛选肿瘤裂解物激活DC共培养的CTLs中IκBα和P65结合的lncRNA与T细胞激活前后差异表达lncRNA交集找到NKILA
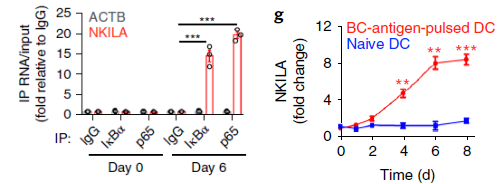
图2 RIP-qPCR及qPCR验证P65/IκBα结合NKILA及NKILA激活过程差异表达
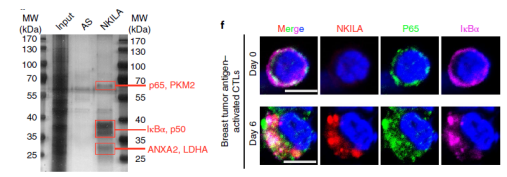
图3 机制实验RNA pull down和FISH定位证明NKILA结合IkBa和P65及三者共定位

图4 In vitro和In vivo功能实验证明NKILA通过NF-κB影响T细胞AICD及肿瘤凋亡/体积增长
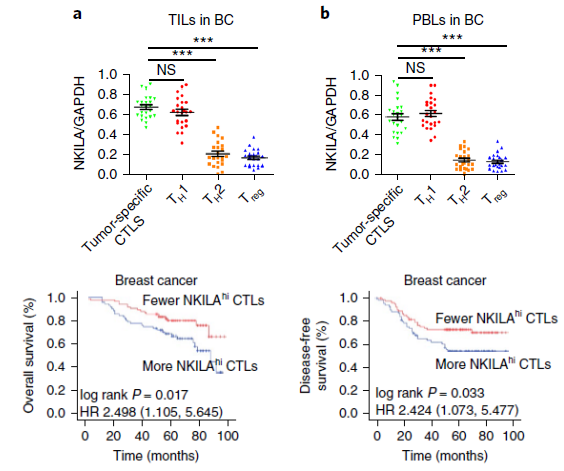
图5 临床应用证明NKILA在不同亚型T细胞中差异表达并影响预后生存期
研究意义
在这项研究中,研究人员通过Arraystar Human LncRNA芯片筛选了抗肿瘤特异性CTLs中结合NF-κB并在激活过程差异表达的lncRNA NKILA,通过功能机制实验验证肿瘤特异性CTLs中NKILA可以通过结合NF-κB从而影响CTLs的AICD过程及影响肿瘤的免疫逃逸,NKILA上游受到TCR激活的钙离子流影响,进而影响钙调素及STAT1与NKILA启动子的结合及NKILA的转录。
原文出处
NKILA lncRNA promotes tumor immune evasion by sensitizing T cells to activation-induced cell death. Nature immunology, 2018

