

|
基因芯片技术服务 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
基因芯片技术服务 DNA甲基化芯片 DNA羟甲基化芯片 ChIP-chip |
NGS测序技术服务 DNA甲基化测序 DNA羟甲基化测序 染色质免疫共沉淀测序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
|
蛋白相对定量 TMT标记定量技术 非标定量技术 |
蛋白修饰 TMT标记定量磷酸化 非标定量磷酸化 |
RNA/蛋白-蛋白相互作用 RNA-蛋白相互作用 蛋白-蛋白相互作用 |
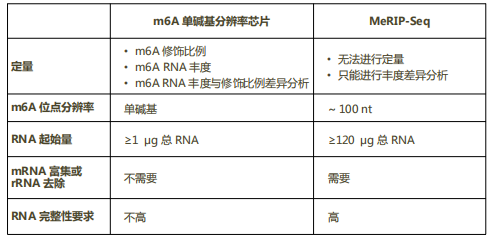
一直以来,在单碱基分辨率水平检测m6A存在诸多技术难点。再加上携带m6A的mRNA/lncRNA丰度较低、m6A甲基基团的反应惰性以及m6A附近RNA结构的干扰等因素,使得在单碱基水平检测m6A愈发困难[1]。目前广泛应用的m6A/MeRIP-seq技术利用m6A抗体对携带m6A修饰的RNA片段进行免疫共沉淀,然后进行RNA测序,将m6A定位在200 nt范围以内[3, 4]。尽管这些技术使得分析m6A表观转录谱成为可能[5-9],但它们既不能精确定位MeRIP-Seq peak里实际发生m6A修饰的腺苷酸,也不能对每个修饰位点进行定量[1]。因此,为了进一步深入了解m6A表观转录组学的生物学功能与分子机制,亟待新的技术,能够在单碱基水平确定m6A的修饰状态和修饰比例。为此,Arraystar开发了m6A单碱基分辨率芯片平台,可在单碱基水平定位m6A修饰,并对修饰位点进行定量。
有限的特异性与灵敏度
由于m6A抗体可能与其它类似修饰(比如m6Am)发生交叉反应[4, 5, 11, 12],因此其反应特异性有限。另外,由于缺少正交实验技术的结果作为独立参考,以m6A抗体为基础的检测技术的灵敏度尚未接受过系统性评估。芯片作为一种抗体非依赖的方法,可满足此类评估需求[5]。
Arraystar解决方案:与以m6A抗体免疫共沉淀为基础的MeRIP或miCLIP等技术不同,芯片利用了RNA酶MazF对m6A的敏感性,首次提供了一种不依赖于抗体的系统性检测m6A的方法。
有限的分辨率
经典的m6A-seq技术可将m6A定位到三碱基至数十碱基的序列窗口内[13, 3, 4, 5]。一些改进方法(比如miCLIP-seq)通过将m6A抗体和其结合的RNA交联,从而在修饰位点附近诱导序列突变或发生截断,可实现近乎单碱基分辨率的检测水平[12, 14]。然而,这些突变或截断类型十分复杂,不同位点之间差异很大,常分散在3~4碱基的序列窗口内[12, 14]。
Arraystar解决方案:对经MazF酶处理的,因具有m6ACA序列而未被切割的RNA片段,以及未经MazF酶处理的Input RNA,进行双色标记,然后与Arraystar单碱基分辨率芯片杂交,从而得到单碱基分辨率水平的m6A定量值。
无法进行m6A定量
m6A/MeRIP-seq技术不能对m6A进行定量,无法检测m6A修饰位点的修饰比例。这些信息的缺失严重阻碍了m6A位点的功能探究,以及回答应激条件下m6A如何通过被添加、识别或移除而实现动态调控等问题[7, 15, 16]。
Arraystar解决方案:根据每个被检测位点的双色杂交信号,可以对m6A的修饰比例和丰度进行定量,解决了检测m6A动态变化这个长期未得到满足的需求。
需要大量RNA样本
m6A/MeRIP-seq实验需要大量的RNA样本(> 120 ug总RNA)[3, 4, 12-14],不适用于来源有限的样本,比如珍贵的临床样本,特别是组织部位或低产量筛选细胞。尽管一些改进方法已大幅减少了m6A/MeRIP-seq实验所需的RNA量[17, 18],目前尚无方法可在单碱基分辨率水平检测这些限量样本的m6A表达谱。
解决方案:
Arraystar芯片所需的样本量低至1 ug总RNA。MazF酶具有高灵敏度和特异性,对ng或pg级别的微量RNA也能正常发挥功能。由于不包含免疫沉淀步骤,这种方法简单便捷,且所需的RNA量大大减少,适用于稀有样本,珍贵病理样本,尤其是组织部位、低产量的筛选细胞以及小的动物模型样本等。
Arraystar m6A单碱基分辨率芯片与MeRIP-seq技术比较
参考文献
[1] Liu N, Parisien M, Dai Q, et al. Probing N6-methyladenosine RNA modification status at single nucleotide resolution in mRNA and long noncoding RNA[J]. RNA, 2013,19(12):1848-1856.
[2] Henri Grosjean (Editor) - Fine-Tuning of RNA Functions by Modification and Editing (Topics in Current Genetics)-Springer (2005)[J].
[3] Meyer K D, Saletore Y, Zumbo P, et al. Comprehensive analysis of mRNA methylation reveals enrichment in 3' UTRs and near stop codons[J]. Cell, 2012,149(7):1635-1646.
[4] Dominissini D, Moshitch-Moshkovitz S, Schwartz S, et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq[J]. Nature, 2012,485(7397):201-206.
[5] Garcia-Campos M A, Edelheit S, Toth U, et al. Deciphering the "m(6)A Code" via Antibody-Independent Quantitative Profiling[J]. Cell, 2019,178(3):731-747.
[6] Knuckles P, Buhler M. Adenosine methylation as a molecular imprint defining the fate of RNA[J]. FEBS Lett, 2018,592(17):2845-2859.
[7] Schwartz S. Cracking the epitranscriptome[J]. RNA, 2016,22(2):169-174.
[8] Meyer K D, Jaffrey S R. Rethinking m(6)A Readers, Writers, and Erasers[J]. Annu Rev Cell Dev Biol, 2017,33:319-342.
[9] Yue Y, Liu J, He C. RNA N6-methyladenosine methylation in post-transcriptional gene expression regulation[J]. Genes Dev, 2015,29(13):1343-1355.
[10] Imanishi M, Tsuji S, Suda A, et al. Detection of N(6)-methyladenosine based on the methyl-sensitivity of MazF RNA endonuclease[J]. Chem Commun (Camb), 2017,53(96):12930-12933.
[11] Schwartz S, Bernstein D A, Mumbach M R, et al. Transcriptome-wide mapping reveals widespread dynamic-regulated pseudouridylation of ncRNA and mRNA[J]. Cell, 2014,159(1):148-162.
[12] Linder B, Grozhik A V, Olarerin-George A O, et al. Single-nucleotide-resolution mapping of m6A and m6Am throughout the transcriptome[J]. Nat Methods, 2015,12(8):767-772.
[13] Schwartz S, Agarwala S D, Mumbach M R, et al. High-resolution mapping reveals a conserved, widespread, dynamic mRNA methylation program in yeast meiosis[J]. Cell, 2013,155(6):1409-1421.
[14] Ke S, Alemu E A, Mertens C, et al. A majority of m6A residues are in the last exons, allowing the potential for 3' UTR regulation[J]. Genes Dev, 2015,29(19):2037-2053.
[15] Grozhik A V, Jaffrey S R. Distinguishing RNA modifications from noise in epitranscriptome maps[J]. Nat Chem Biol, 2018,14(3):215-225.
[16] Meyer K D, Jaffrey S R. The dynamic epitranscriptome: N6-methyladenosine and gene expression control[J]. Nat Rev Mol Cell Biol, 2014,15(5):313-326.
[17] Zeng Y, Wang S, Gao S, et al. Refined RIP-seq protocol for epitranscriptome analysis with low input materials[J]. PLoS Biol, 2018,16(9):e2006092.
[18] Merkurjev D, Hong W T, Iida K, et al. Synaptic N(6)-methyladenosine (m(6)A) epitranscriptome reveals functional partitioning of localized transcripts[J]. Nat Neurosci, 2018,21(7):1004-1014.

