

概述
长链非编码RNA (LncRNA)是一类真核生物中长度大于200 nt的非编码RNA分子;根据其与邻近基因的位置可以分为反义lncRNA、增强子lncRNA、基因间lncRNA、双向lncRNA、和内含子lncRNA;它具有多种作用机制,比如在细胞核中作为分子支架、协助可变剪接、调节染色体结构,或在细胞质中调控翻译、促进或抑制mRNA降解、吸附miRNA等。LncRNA具有谱系特异性,参与调控基因组印记、干细胞多潜能分化、胚胎发育[1]、心脏发育[2]、造血与免疫系统[3]以及内分泌系统[4]等多种生物生理学过程。在一系列疾病,比如神经退行性疾病、心血管疾病[5]、肾脏疾病、糖尿病和肿瘤[6]中,都发现了lncRNA的表达紊乱。检测不同细胞或疾病状态下的lncRNA表达量有助于理解其功能、揭示其作用机理、或鉴定有效的分子标志物。
LncRNA分类
虽然关于lncRNA已有很多研究,然而目前只有少量lncRNA的功能完全明晰。依据其与邻近基因的位置关系,可将lncRNA分为反义lncRNA、 增强子lncRNA、基因间lncRNA、双向lncRNA和内含子lncRNA (图一)。LncRNA的位置关系与其作用机制密切相关。比如,增强子lncRNA可以介导其来源的增强子区与基因组上的其他调控元件发生短距或长距的相互作用。另外,有些lncNRA可不依赖其转录产物发挥作用,而是通过转录过程本身影响染色体的易接近性或其它蛋白的结合。根据细胞定位的不同,还可将lncRNA分为细胞核lncRNA和细胞质lncRNA。有些lncRNA则在两个区域同时存在。

图一 根据基因组位置对lncRNA进行分类。反义lncRNA转录自蛋白编码基因的反义链,常与一个或多个正义链上的内含子或外显子重叠。增强子lncRNA位于基因的增强子区。基因间lncRNA位于两个蛋白编码基因之间。双向lncRNA与邻近基因的转录方向相反,位于邻近基因启动子1kb范围内。内含子lncRNA位于编码基因的内含子区。
LncRNA作用机制
LncRNA通过二级或三级结构发挥多种作用机制。大部分lncRNA位于细胞核内,可以作为分子支架、协助可变剪接或调节染色质结构。有些lncRNA也可在细胞质中发挥功能,比如调控翻译,促进或抑制mRNA降解,或者吸附miRNA等(图二)。
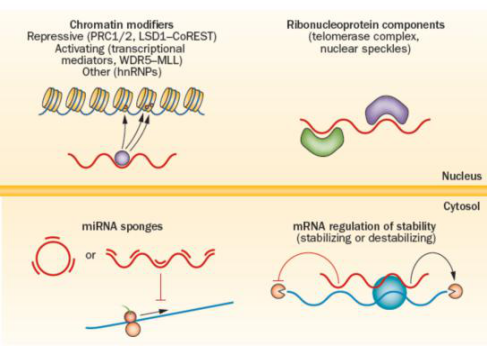
图二 lncRNA作用机制。大部分lncRNA位于细胞核内,招募染色质调控因子到DNA。这些染色质调控因子具有抑制或激活转录功能,或者作为核组织因子发挥作用。一些lncRNA还可与特异性蛋白结合,作为核糖核蛋白复合体的支架。在细胞质中,lncRNA通过吸附miRNA,抑制其对其靶向mRNA的作用。一些lncRNA还通过抑制或增强mRNA的稳定性,从而调节mRNA的半衰期。
LncRNA的生物生理学功能
LncRNA参与多种生物生理过程,在基因组印记、X染色体失活、干细胞分化、胚胎发育、脂类代谢和脂肪生成过程中发挥重要功能。
基因组印记和染色体失活
基因组印记是一种重要的发育调控机制,大部分的印记基因参与胚胎发育[7]。目前发现有些lncRNA与基因组印记有关。比如lncRNA Airn为父系来源染色体上gf2r/Slc22a2/Slc22a3基因座的印记沉默所必需。而反义lncRNA Kcnq1ot1参与调控父系染色体上印记沉默区Kcnq1基因的功能。在雌性哺乳动物发育过程中,Xist可导致失活X染色体上的大部分基因表达受抑制,而活性X染色体上的基因表达则不受其影响。
干细胞多潜能分化
超过100多种lncRNA的启动子区可与干细胞因子结合。这些lncRNA的表达失调会导致细胞的分化状态改变[8]。其中,lincRNA-RoR参与纤维母细胞的干细胞重编程,使纤维母细胞恢复至多潜能状态。因此,这些lncRNA在正常发育和成体干细胞库的更新维持中都发挥重要功能。
胚胎发育
由HOX基因编码的转录因子家族参与调控胚胎发育和细胞定向分化[3]。一些lncRNA直接参与HOX基因的转录表达调控。比如lncRNA HOTTIP与WDR5 (组蛋白修饰复合物MLL1的关键组分之一)结合,催化HOXA基因座的H3K4me3标记,维持HOXA基因的转录激活状态。另外一个lncRNA HOTAIR,可以招募抑制性复合物PRC2,抑制HOXD基因的转录。
脂类代谢和脂肪生成
最新的研究表明,lncRNA控制肝脏中的脂类代谢,调控脂肪生成,从而维持机体的脂质稳态[9]。APOA1编码蛋白是高密度脂蛋白的重要组分。其反义转录本APOA1-AS可以在体内和体外抑制APOA1的表达。LncRNA NEAT1在脂肪生成过程中调节PPARγ2的可变剪接,它还介导miR-140诱导的脂肪生成。
造血与免疫系统
lncRNA参与造血免疫系统的不同发育阶段和不同激活阶段[3]。例如,Lnc-DC可以促进树突状细胞转录因子STAT3的磷酸化与细胞核迁移,从而调控树突状细胞的分化。在LPS刺激后的人巨噬细胞中,lncRNA PACER表达明显上调,可特异性的激活邻近基因COX-2的表达。另外,lncRNA THRIL与hnRNP因子相互作用,为炎症-细胞因子编码基因TNF的基底水平表达和诱导性表达所必需。
心脏发育与功能
研究人员在心脏发育过程中发现了数百种差异表达的lncRNA,然而目前只有少量lncRNA功能被研究清楚[2]。比如,lncRNA BVHT在心脏中胚层、胚胎干细胞和心肌细胞中都有表达。敲除BVHT严重损害胚胎干细胞产生心肌细胞的能力。另外,lncRNA FENDRR与心脏谱系发育紧密关联。它只表达于心脏中胚层前体细胞,控制着侧中胚层来源组织(比如心脏)的分化形成。
LncRNA与疾病
近年来,虽然lncRNA与疾病的研究已获得初步成效,然而lncRNA疾病整体研究才刚刚起步,需要更多的研究来揭示lncRNA在疾病中的功能,寻找有效的药物靶点和分子标志物。接下来的部分,我们总结了lncRNA在多种威胁人类安全的疾病中lncRNA的研究现状。
肿瘤
从本质上说,肿瘤是一类基因性疾病,通过改变细胞内的信息流,从而改变细胞稳态和促进细胞增殖。癌症全基因组突变分析表明大部分的突变位点位于蛋白非编码区域。这些突变会对lncRNA的表达产生显著影响。LncRNA除了参与肿瘤的恶性转化,还与癌症细胞生长、增殖、侵袭和生存等多种表型有关[6](图三)。比如,在急性T细胞淋巴癌中,癌基因Notch 1诱导lncRNA LUNAR1的表达,从而上调胰岛素样生长因子受体1的表达。在前列腺癌中,PCGEM1, PRNCR1, HOTAIR等lncRNA可以直接激活雌激素受体,而CTBP1-AS等lncRNA则可以捕获雌激素受体抑制蛋白,共同激活雌激素受体信号通路,促进肿瘤增殖。
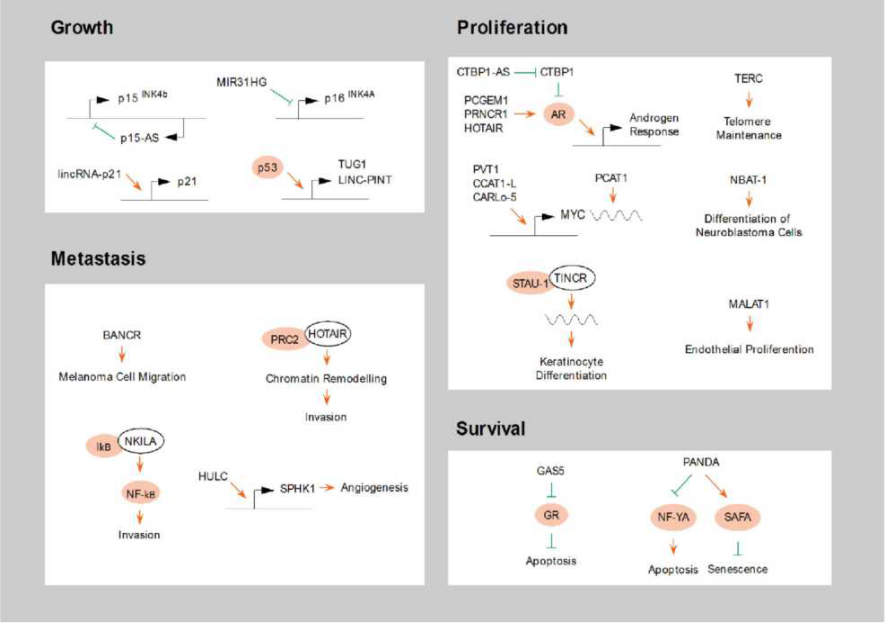
图三 LncRNA在肿瘤中的作用
神经退行性疾病
在大脑发育、神经元功能维持以及中枢神经系统发育过程中,lncRNA也发挥着关键作用。越来越多的证据表明,lncRNA参与阿尔兹海默症、帕金森症和亨廷顿症等多种神经退行性疾病的病理过程[10]。蛋白编码基因BACE1的反义转录本BACE1-AS在阿尔兹海默症病人中高表达。不像其他的反义转录本与其正义链mRNA互补成双链从而抑制其翻译过程,BACE1-AS可以增强mRNA BACE1的稳定性,产生更多的Aβ42。因此,BACE1-AS可能与加速阿尔兹海默症的疾病进程有关。
心血管类疾病
许多lncRNA已被证明可显著影响心脏衰竭和心肌梗塞等心血管疾病[5]。在一个心肌梗塞的小鼠模型中,研究人员发现了两个显著上调的lncRNA Mirt1和MIrt2。这两个lncRNA在发生心肌梗塞24小时候达到峰值,在两天后恢复到基底水平。在另外一个心脏压力过载与心肌梗塞的小鼠模型中,重新激活胎儿心脏的转录组,会导致胎儿心脏增强子相关的lncRNA转录本的高表达,提示这些lncRNA可能在心肌梗塞向心脏衰竭转变过程中发挥关键作用。
肾脏疾病与糖尿病
糖尿病经常伴随着肾病的发生[5]. 比如基因间lncRNA PVT1与二类疾病都紧密关联。研究人员在II型糖尿病人的晚期肾病进程中发现了PVT1的基因变异。高糖处理可以诱导人的肾间质细胞中PVT1和纤连蛋白1、IV型胶原蛋白、TGF β1、PAI 1等因子的高表达。相反,敲除PVT1可导致这些因子的显著下调。
LncRNA与临床应用
普遍认为lncRNA具有区分不同细胞状态或细胞内生物过程的功能,因此可以用来鉴定病理过程、提供预后评估或者为个体化疗法提供参考。其表达的时空特异性和疾病特异性使其有望成为强有效的分子标志物。已有不少研究揭示,lncRNA在多种疾病生物学标志物的应用中具备潜能(表二)。例如,研究发现LncRNA MT LIPCAR在发生左心室重塑的病人中特异性表达,并随后在788个发生心脏重塑和心脏衰竭的病人中得到验证。血液循环系统中的MT LIPCAR高表达水平可不受其他心血管疾病标志物的干扰,独立预测恶性心脏重塑。这项研究充分表明循环lncRNA具有作为分子标志物的重大潜能。
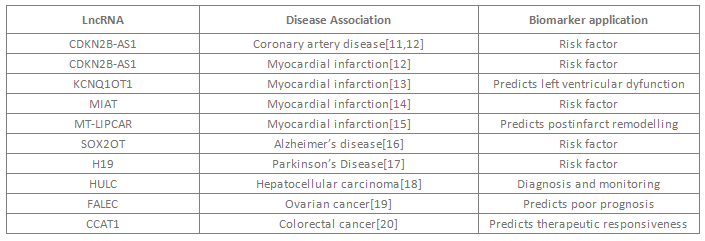
表一 LncRNA在生物学标志物中的潜在应用
参考文献
[1] Fatica A, Bozzoni I. Long non-coding RNAs: new players in cell differentiation and development. Nature reviews Genetics 2014;15:7-21.
[2] Devaux Y, Zangrando J, Schroen B, Creemers EE, Pedrazzini T, Chang CP, et al. Long noncoding RNAs in cardiac development and ageing. Nature reviews Cardiology 2015;12:415-25.
[3] Satpathy AT, Chang HY. Long noncoding RNA in hematopoiesis and immunity. Immunity 2015;42:792-804.
[4] Knoll M, Lodish HF, Sun L. Long non-coding RNAs as regulators of the endocrine system. Nature reviews Endocrinology 2015;11:151-60.
[5] Lorenzen JM, Thum T. Long noncoding RNAs in kidney and cardiovascular diseases. Nature reviews Nephrology 2016;12:360-73.
[6] Schmitt AM, Chang HY. Long Noncoding RNAs in Cancer Pathways. Cancer cell 2016;29:452-63.
[7] Schmitz SU, Grote P, Herrmann BG. Mechanisms of long noncoding RNA function in development and disease. Cellular and molecular life sciences : CMLS 2016;73:2491-509.
[8] Ghosal S, Das S, Chakrabarti J. Long noncoding RNAs: new players in the molecular mechanism for maintenance and differentiation of pluripotent stem cells. Stem cells and development 2013;22:2240-53.
[9] Chen Z. Progress and prospects of long noncoding RNAs in lipid homeostasis. Molecular metabolism 2016;5:164-70.
[10] Wu P, Zuo X, Deng H, Liu X, Liu L, Ji A. Roles of long noncoding RNAs in brain development, functional diversification and neurodegenerative diseases. Brain research bulletin 2013;97:69-80.
[11] Consortium CAD, Deloukas P, Kanoni S, Willenborg C, Farrall M, Assimes TL, et al. Large-scale association analysis identifies new risk loci for coronary artery disease. Nature genetics 2013;45:25-33.
[12] Samani NJ, Erdmann J, Hall AS, Hengstenberg C, Mangino M, Mayer B, et al. Genomewide association analysis of coronary artery disease. The New England journal of medicine 2007;357:443-53.
[13] Vausort M, Wagner DR, Devaux Y. Long noncoding RNAs in patients with acute myocardial infarction. Circulation research 2014;115:668-77.
[14] Ishii N, Ozaki K, Sato H, Mizuno H, Saito S, Takahashi A, et al. Identification of a novel non-coding RNA, MIAT, that confers risk of myocardial infarction. Journal of human genetics 2006;51:1087-99.
[15] Kumarswamy R, Bauters C, Volkmann I, Maury F, Fetisch J, Holzmann A, et al. Circulating long noncoding RNA, LIPCAR, predicts survival in patients with heart failure. Circulation research 2014;114:1569-75.
[16] Arisi I, D'Onofrio M, Brandi R, Felsani A, Capsoni S, Drovandi G, et al. Gene expression biomarkers in the brain of a mouse model for Alzheimer's disease: mining of microarray data by logic classification and feature selection. Journal of Alzheimer's disease : JAD 2011;24:721-38.
[17] Kraus TF, Haider M, Spanner J, Steinmaurer M, Dietinger V, Kretzschmar HA. Altered Long Noncoding RNA Expression Precedes the Course of Parkinson's Disease-a Preliminary Report. Molecular neurobiology 2016.
[18] Xie H, Ma H, Zhou D. Plasma HULC as a promising novel biomarker for the detection of hepatocellular carcinoma. BioMed research international 2013;2013:136106.
[19] Hu X, Feng Y, Zhang D, Zhao SD, Hu Z, Greshock J, et al. A functional genomic approach identifies FAL1 as an oncogenic long noncoding RNA that associates with BMI1 and represses p21 expression in cancer. Cancer cell 2014;26:344-57.
[20] McCleland ML, Mesh K, Lorenzana E, Chopra VS, Segal E, Watanabe C, et al. CCAT1 is an enhancer-templated RNA that predicts BET sensitivity in colorectal cancer. The Journal of clinical investigation 2016;126:639-52.