

|
基因芯片技术服务 DNA甲基化芯片 DNA羟甲基化芯片 ChIP-chip |
NGS测序技术服务 DNA甲基化测序 DNA羟甲基化测序 染色质免疫共沉淀测序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
| TMT标记定量技术 非标定量技术 |
蛋白修饰 TMT标记定量磷酸化 非标定量磷酸化 |
RNA/蛋白-蛋白相互作用 RNA-蛋白相互作用 蛋白-蛋白相互作用 |
背景
环状RNA(circRNA)是区别于传统线性RNA的一类新型RNA,具有闭合环状结构,大量存在于真核转录组中。大部分的环状RNA是由外显子序列构成,在不同的物种中具有保守性,同时存在组织及不同发育阶段的表达特异性。由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。此外,近期研究显示,环状RNA在不同物种中起到miRNA海绵的作用,称之为竞争性內源RNA(ceRNA),能竞争性结合miRNA,从而调控靶基因的表达。这说明:环状RNA可能通过竞争性结合疾病相关的miRNA在疾病调控中发挥着非常重要的作用。
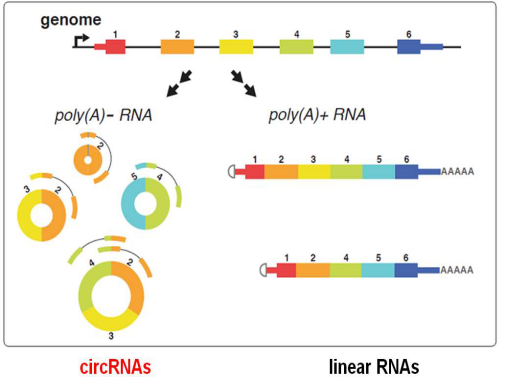
图释:circRNA在哺乳动物细胞中的形成
circRNA特征
circRNA没有“尾巴”
常规存在于线性RNA分子中的3’和5’端在环状RNA中被连接形成了闭合环状结构(图1)。而经典的RNA检测方法只能分离具有PolyA“尾巴”结构的RNA分子,所以环转RNA在以往的研究中通常被忽略了。
circRNA不翻译
虽然很多circRNA是由蛋白编码基因产生,但是还没有结果显示circRNA在细胞中编码蛋白。环状RNA也因此被定义为一类新型非编码RNA.
circRNA的细胞定位和稳定性
大部分环状RNA在细胞浆中富集,其丰度有时甚至比相应的线性mRNA高10余倍,这可能是由于环状RNA比线性RNA更稳定造成的。核酸酶往往通过识别线性RNA分子末端发挥作用,环状RNA是一个闭合结构,因此对核酸酶具有高耐受性。
circRNA作为内源性竞争RNA(ceRNA)
环状RNA在细胞质中富集,同时与对应的线性RNA具有相同的转录序列,说明环状RNA很有可能是通过影响miRNA的结合来行使功能。近来发现的一个环状RNA-CDR1as (也称为ciRS-7) ,在其序列上有超过60个保守的miR-7结合位点,因此起到有效的miR-7海绵作用,能够影响miR-7靶标基因活性。在斑马鱼实验中,该环状RNA的表达能够损害中脑发育,与敲除miR-7效果一致。此外,Sry 也被证实起到miR-138的海绵作用。通过高通量测序和生物信息学分析手段,研究者们在哺乳动物转录组中发现了数以千计的环状RNA,说明环状RNA很有可能就是一类新的调控型內源竞争性RNA(ceRNA)。更为重要的是,由于环状RNA的高表达和稳定特性,它在与其它的线性內源竞争性RNA共同作用过程中能够显示异常突出的ceRNA活性。
除了ceRNA活性,环状RNA也有可能与RNA结合蛋白RBPs结合,或与其它RNA碱基互补结合甚至结合RNA的翻译蛋白,从而影响基因的正常功能。
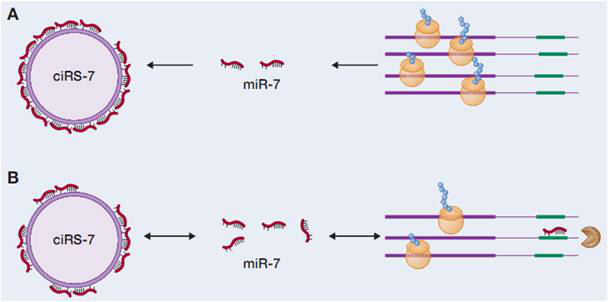
图释:ciRS-7 的miR-7海绵作用
circRNA与疾病
近来研究开始关注于circRNA可能在疾病病理方面起到的作用。例如,环状ANRIL(cANRIL)是长链非编码RNA ANRIL的环状拼接形式,其在人类细胞中的表达与该位点上几个可能影响ANRIL拼接的SNP有关,能调节INK4/ARF的水平并增加动脉粥样硬化的风险。这项研究充分证明circRNA与疾病的发生存在关联,并能很好地作为疾病新型生物标记。
此外,更多的证据显示,环状RNA在miRNA水平的微调上起着非常重要的作用,通过竞争结合miRNA来调控基因的表达。而与疾病关联miRNA的相互作用则说明环状RNA能够参与疾病调节。例如,环状RNA ciRS-7在人脑组织中丰富表达,与脑特异性microRNA miR-7相互作用;而ciRS-7含有多个串联的miR-7结合位点,因此可以作为内源性的miRNA海绵,抑制miR-7活性。考虑到miR-7是各种不同癌症相关通路的重要调节因子,同时也因能直接调节a-突触核蛋白和泛素蛋白连接酶A(UBE2A)的表达而可能与帕金森和阿兹海默疾病的发生相关,所以ciRS-7也很有可能作为神经性系统疾病和癌症发生的重要调节因子。
参考文献
1. Jeck, W. R., J. A. Sorrentino, et al. (2013). "Circular RNAs are abundant, conserved, and associated with ALU repeats." RNA 19(2): 141-157.
2. Ledford, H. (2013). "Circular RNAs throw genetics for a loop." Nature 494(7438): 415.
3. Perkel, J. M. (2013). "Assume nothing: the tale of circular RNA." Biotechniques 55(2): 55-57.
4. Salmena, L., L. Poliseno, et al. "A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language?" Cell 146(3): 353-358.
5. Wilusz, J. E. and P. A. Sharp (2013). "Molecular biology. A circuitous route to noncoding RNA." Science 340(6131): 440-441.

