

概述
转运RNA (tRNA)是一种参与解码mRNA、翻译蛋白质的接头分子。近年来的研究表明tRNA还能作为小非编码RNA (sncRNA)的主要来源之一,具有独特且多样的功能1。这些tRNA来源的ncRNA并非随机降解的产物,而是通过精确的生物发生过程产生的 (图1) 。源自tRNA的ncRNA大致分为两大类:tiRNA (或者tRNA halves) 和tRFs (tRNA 衍生片段) ,具有其特定的分子大小、核苷酸组成、生理功能以及生物发生1-3。
tRNA halves (tiRNAs)是由angiogenin (ANG)在多种应激条件下在成熟tRNA的反密码子环处特异性切割产生的5’-和3’- tRNA半分子,长度约为29-50nt。
tRFs长度约16-28nt,来源于成熟tRNA或前体tRNA,根据其在tRNA上的对应位置可进一步分为:(i) tRF-5,对应成熟tRNA的5’端,切割发生在D-loop;(ii) tRF-3,对应成熟tRNA的3’端,包含CCA部分,切割发生在T-loop;(iii) tRF-1,源自前体tRNA的3’尾部序列,3’末端含有多聚U序列;(iv) i-tRF,不属于tRF-5,tRF-3或tRF-1,主要来自成熟tRNA的中间区域。
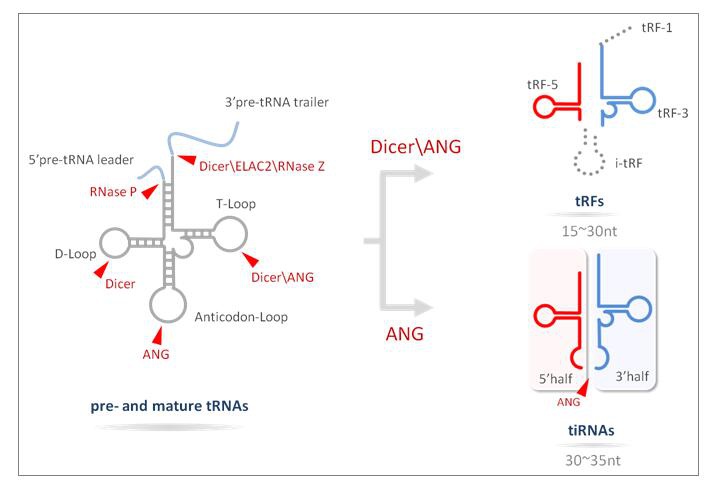
图1. tRF&tiRNA的生物发生过程。tRF-1产生于前体tRNA的3’尾端序列。tRF-5,i-tRF和tRF-3分别起源自成熟tRNA的5’、内部、和3’端。当切割发生在成熟tRNA反密码子环,将产生两个半分子,tiRNAs,包括5’-tRFs和3’-tRFs。
生物功能
tRFs和tiRNAs作为sncRNA执行多种生物学功能 (图7) 。它们能够作为miRNA行使RNA干扰(图2) ;替换与mRNA结合的翻译起始因子eIF4G,直接抑制蛋白的翻译过程4,5;结合某些蛋白因子,例如YBX1,影响mRNA的稳定性 (图3) ;与细胞色素C相互作用,调控细胞凋亡6;在应激条件下促进应激颗粒 (Stress Granules, SGs) 的组装 (图4) ;敏化细胞氧化应激诱导的p53激活以及p53依赖的细胞死亡7;作为父代表观遗传因子,改变子代基因转录级联过程8,9(图6)

图2. tRFs具有许多microRNA的功能特性,例如,Dicer依赖的生物发生,与Argonaute蛋白形成RISC复合体以及RNA沉默。某些收录的miRNA直接与tRFs匹配10。
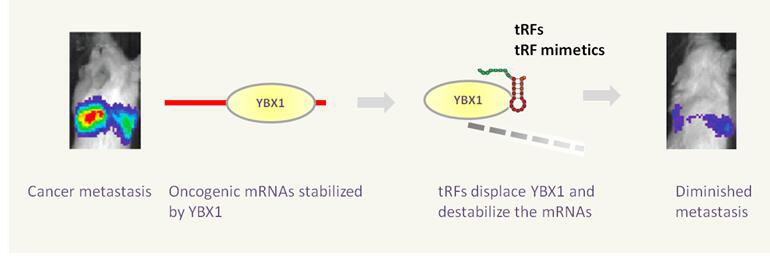
图3. tRFs或者其类似物替换肿瘤基因mRNA结合蛋白YBX1,使许多促癌基因mRNA不稳定,进而癌细胞的浸润性被显著抑制11。

图4. 在细胞应激条件下,tRNA halves (tiRNAs)由angiogenin 切割tRNA产生,随后促进Stress Granules (SGs)的组装,诱导翻译抑制,细胞修复和存活12。
人类疾病
tRFs&tiRNAs与多种病理状况相关,甚至是致病因素,例如,癌症、神经退行性疾病、遗传性代谢疾病等 (图5)。
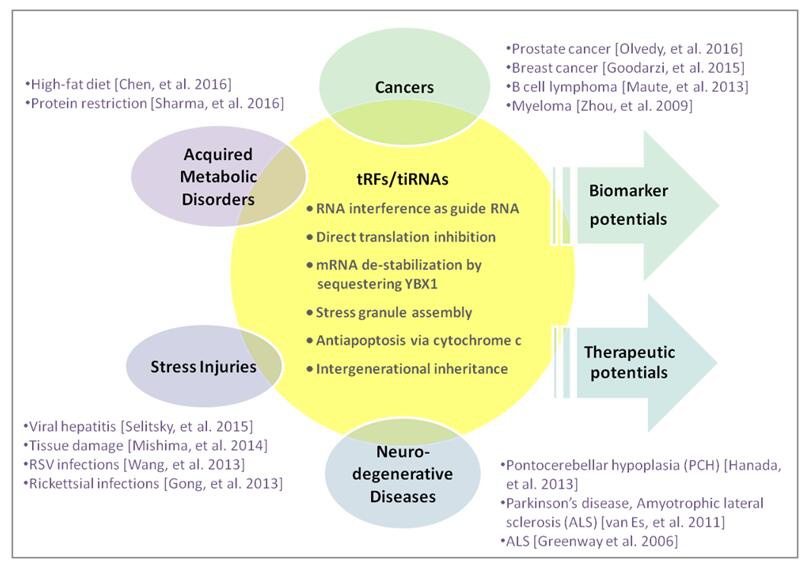
图5. tRFs&tiRNAs分子功能和人类疾病。
癌症
tRFs&tiRNAs在多种癌细胞系中差异表达,例如前列腺癌细胞系LNCaP和C4-2等。tRFs&tiRNAs在应激条件下表达水平升高,尤其是在缺氧等氧化应激条件下13。此外,一种在B细胞淋巴癌细胞系中发现的tRF-3具有前导RNA的功能特性,以miRNA的方式抑制细胞增殖,调控DNA损伤应答14。通过竞争YBX1结合位点、降低肿瘤基因转录产物稳定性,tRFs&tiRNAs可作为肿瘤抑制物11(图. 3)。一种来自tRNA-Ser前体的tRF-1 (tRF-1001)在多种癌细胞系中高表达,并且是前列腺癌细胞增殖所必须的15。ANG产生的tiRNAs促进SGs的组装,帮助细胞在不利条件下存活,据推测,ANG诱导的tiRNAs直接贡献于ANG介导的血管生成和癌细胞增殖。类似的,tiRNAs能够结合细胞色素C,并帮助癌细胞逃避细胞调亡6。综上所述,这些重要发现强烈预示了tRFs&tiRNAs在肿瘤发生过程中的关键作用。
获得性代谢疾病
不断增长的证据表明,子代的代谢疾病可源自亲本的饮食习惯。在一个父本高脂饮食(HFD)小鼠模型中的研究显示,精子中存在一类主要来自tRNA 5’端、长度在30-34nt的tRFs&tiRNAs,在高脂饮食条件下表现出差异表达和RNA修饰变化。将HFD小鼠精子中的tRFs&tiRNAs组分注射到正常受精卵中,可引起F1小鼠的代谢疾病,改变早期胚胎和胰岛细胞代谢通路基因表达谱,并且独立于CpG富集区DNA甲基化机制。因此,精子tRFs&tiRNAs代表着一类亲本的表观遗传因子,介导饮食诱导的代谢疾病向子代遗传8(图. 6)。
限制小鼠饮食蛋白水平能够改变小鼠成熟精子中小RNA含量,let-7表达降低,而Glycine tRNA来源的5’端tRFs&tiRNAs表达量升高。tRFs&tiRNAs被认为在着床前胚胎转录组表达调控中起着内 源逆转录驱动作用9。
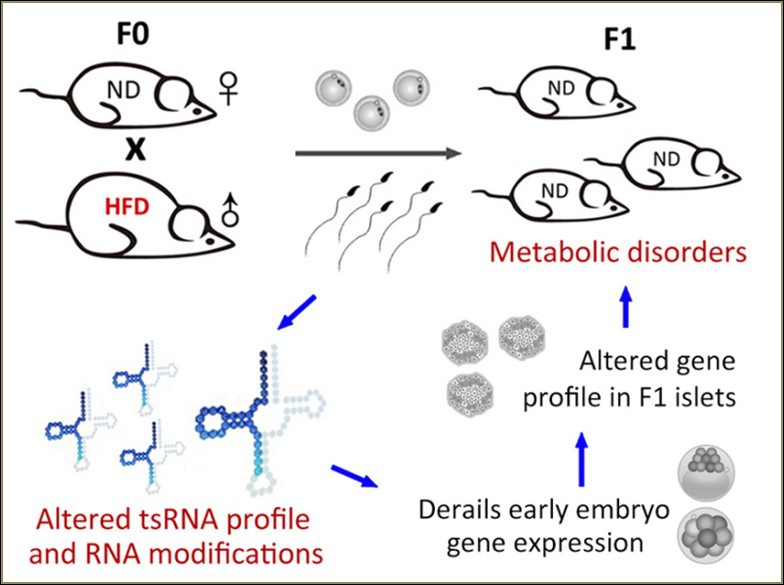
图6. 高脂饮食(HFD)小鼠精子中tRNA来源的小RNA (tsRNAs,主要是tRNA halves)具有变化的表达谱和RNA修饰。通过受精卵注射技术,tRFs&tiRNAs赋予了子代代谢疾病表型。这些表观遗传因子通过改变从胚胎到成年的基因级联转录过程来介导亲本到子代的遗传过程8。
神经性病变
许多神经性病变是由tRNA代谢或tRNA加工酶缺陷造成的。一种RNA酶活性降低的ANG突变体与致死性神经退行性病变Amyotrophic Lateral Sclerosis (ALS)的病理过程相关联16。一类ALS相关的ANG突变体同时还在Parkinson’s Disease (PD)病人中发现17。随着研究的不断深入,ANG诱导的tRNA halves与细胞应激反应、神经发育疾病之间的联系得到进一步加强18。CLP1 RNA激酶活性丧失,导致一种异常加工的酪氨酸tRNA前体来源的小RNA片段的积累,进而敏化细胞氧化应激诱导的p53激活和p53介导的神经细胞死亡,诱发运动神经元丢失,肌肉去神经化以及呼吸衰竭7。另外一个案例是,5-胞嘧啶甲基转移酶NSun2的突变引起的头小畸形(microcephaly)和其他神经性异常。在NSun2缺失突变体大脑皮层、海马和纹状体神经元中,tRNA胞嘧啶5位甲基化的缺失,增强ANG对tRNA的结合和剪切,导致5’-halves的积累,进而降低蛋白翻译速率,激活应激通路,减小细胞体积,促进细胞凋亡19。
病理应激损伤
由缺氧、营养匮乏、氧化及代谢失衡等引起的应激反应能够损伤细胞,催生疾病。这些应激条件刺激tRNA halves的产生。在毒性损伤、辐射以及缺血再灌注等组织损伤动物模型中,tRNA halves的产生与组织损伤程度呈现相关性,例如,应激导致tRNA构象改变,随后促进ANG介导的tRNA halves的产生1。5’-halves的表达上调与病毒及立克次体感染显著相关,可能与抑制凋亡,促进细胞存活有关。tRFs&tiRNAs、主要是30-35nt长的5’ halves在非恶性肝脏中具有高的表达量,而且在慢性病毒性肝炎中表达水平迅速上升18。
生物标志物潜力
tRFs&tiRNAs的组成和数量高度依赖于细胞类型和疾病状态20。特别的,tRNA和tRF&tiRNA类群高度富集与生物体液中,有时甚至高于miRNA的含量13,21,22。尽管目前对体液型生物标志物的筛选主要集中在miRNA上,但是,tRFs&tiRNAs在多种体液中的高当量高稳定性,在病理过程中的广泛参与,在实体瘤和血液恶性肿瘤中的差异表达,以及在癌症病人和正常对照之间的强大分辨能力,为人们尝试开发低侵入性的、基于tRFs&tiRNAs的生物标志物开辟了广阔的前景。例如,PLS-DA分析发现tRFs&tiRNAs的表达谱能够清楚的分辨三阴(阳)性乳腺癌与正常对照20(图7B,C);研究显示,不同tRFs&tiRNAs之间的比例关系能够作为一个高效的癌症无进展生存期(PFS)指标和诊断标志物候选者13。
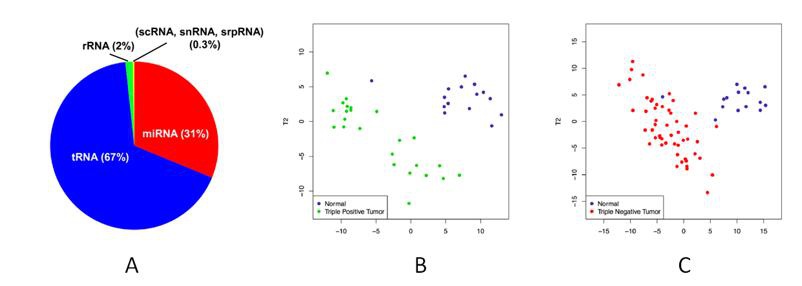
图7. (A)血浆中存在丰富的tRNA衍生片段RNA21。在PLS-DA判别分析中tRFs&tiRNAs表达谱能够清晰的分辨三阳性乳腺癌 (B)以及三阴性乳腺癌 (C)与健康对照。
如何研究tRFs&tiRNAs
康成生物的tRF&tiRNA–seq服务系统对tRF&tiRNA进行定性定量的表达谱分析,同时对tRF&tiRNA亚家族及未知tRF&tiRNA进行鉴定。借助丰富的数据和信息,那些差异表达的tRFs&tiRNAs能够被鉴定,并使用图示的方法进行下一步的深入研究 (图. 8) 。许多已经建立好的方法都和miRNA类似,例如,qPCR验证,LNA寡核苷酸基因敲除,合成的类似物进行功能获得性研究等。
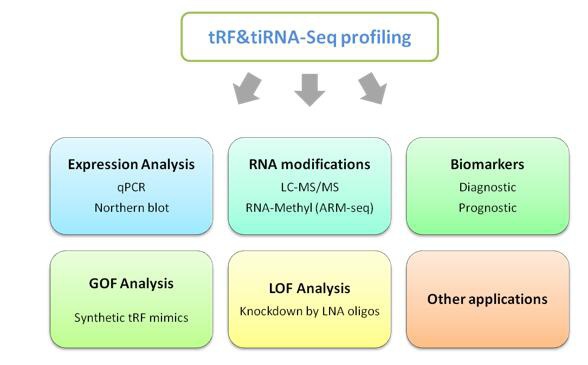
图8. tRF&tiRNA下一步研究技术路线
参考文献
1. Anderson, P. & Ivanov, P. tRNA fragments in human health and disease. FEBS letters 588, 4297-4304, doi:10.1016/j.febslet.2014.09.001 (2014).
2. Pliatsika, V., Loher, P., Telonis, A. G. & Rigoutsos, I. MINTbase: a framework for the interactive exploration of mitochondrial and nuclear tRNA fragments. Bioinformatics, doi:10.1093/bioinformatics/btw194 (2016).
3. Zheng, L. L. et al. tRF2Cancer: A web server to detect tRNA-derived small RNA fragments (tRFs) and their expression in multiple cancers. Nucleic acids research, doi:10.1093/nar/gkw414 (2016).
4. Gebetsberger, J., Zywicki, M., Kunzi, A. & Polacek, N. tRNA-derived fragments target the ribosome and function as regulatory non-coding RNA in Haloferax volcanii. Archaea 2012, 260909, doi:10.1155/2012/260909 (2012).
5. Sobala, A. & Hutvagner, G. Small RNAs derived from the 5' end of tRNA can inhibit protein translation in human cells. RNA Biol 10, 553-563, doi:10.4161/rna.24285 (2013).
6. Saikia, M. et al. Angiogenin-cleaved tRNA halves interact with cytochrome c, protecting cells from apoptosis during osmotic stress. Molecular and cellular biology 34, 2450-2463, doi:10.1128/MCB.00136-14 (2014).
7. Hanada, T. et al. CLP1 links tRNA metabolism to progressive motor-neuron loss. Nature 495, 474-480, doi:10.1038/nature11923 (2013).
8. Chen, Q. et al. Sperm tsRNAs contribute to intergenerational inheritance of an acquired metabolic disorder. Science 351, 397-400, doi:10.1126/science.aad7977 (2016).
9. Sharma, U. et al. Biogenesis and function of tRNA fragments during sperm maturation and fertilization in mammals. Science 351, 391-396, doi:10.1126/science.aad6780 (2016).
10. Venkatesh, T., Suresh, P. S. & Tsutsumi, R. tRFs: miRNAs in disguise. Gene 579, 133-138, doi:10.1016/j.gene.2015.12.058 (2016).
11. Goodarzi, H. et al. Endogenous tRNA-Derived Fragments Suppress Breast Cancer Progression via YBX1 Displacement. Cell 161, 790-802, doi:10.1016/j.cell.2015.02.053 (2015).
12. Emara, M. M. et al. Angiogenin-induced tRNA-derived stress-induced RNAs promote stress-induced stress granule assembly. J Biol Chem 285, 10959-10968, doi:10.1074/jbc.M109.077560 (2010).
13. Olvedy, M. et al. A comprehensive repertoire of tRNA-derived fragments in prostate cancer. Oncotarget, doi:10.18632/oncotarget.8293 (2016).
14. Maute, R. L. et al. tRNA-derived microRNA modulates proliferation and the DNA damage response and is down-regulated in B cell lymphoma. Proceedings of the National Academy of Sciences of the United States of America 110, 1404-1409, doi:10.1073/pnas.1206761110 (2013).
15. Lee, Y. S., Shibata, Y., Malhotra, A. & Dutta, A. A novel class of small RNAs: tRNA-derived RNA fragments (tRFs). Genes & development 23, 2639-2649, doi:10.1101/gad.1837609 (2009).
16. Greenway, M. J. et al. ANG mutations segregate with familial and 'sporadic' amyotrophic lateral sclerosis. Nature genetics 38, 411-413, doi:10.1038/ng1742 (2006).
17. van Es, M. A. et al. Angiogenin variants in Parkinson disease and amyotrophic lateral sclerosis. Annals of neurology 70, 964-973, doi:10.1002/ana.22611 (2011).
18. Selitsky, S. R. et al. Small tRNA-derived RNAs are increased and more abundant than microRNAs in chronic hepatitis B and C. Scientific reports 5, 7675, doi:10.1038/srep07675 (2015).
19. Blanco, S. et al. Aberrant methylation of tRNAs links cellular stress to neuro-developmental disorders. The EMBO journal 33, 2020-2039, doi:10.15252/embj.201489282 (2014).
20. Telonis, A. G. et al. Dissecting tRNA-derived fragment complexities using personalized transcriptomes reveals novel fragment classes and unexpected dependencies. Oncotarget 6, 24797-24822, doi:10.18632/oncotarget.4695 (2015).
21. Dhahbi, J. M. et al. 5' tRNA halves are present as abundant complexes in serum, concentrated in blood cells, and modulated by aging and calorie restriction. BMC genomics 14, 298, doi:10.1186/1471-2164-14-298 (2013).
22. Schageman, J. et al. The complete exosome workflow solution: from isolation to characterization of RNA cargo. BioMed research international 2013, 253957, doi:10.1155/2013/253957 (2013).