

|
单细胞测序技术服务 靶向lncRNA单细胞全转录组测序 单细胞全转录组测序 |
|
生物分子凝聚体研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 CoIP-MS/AP-MS |
|
NGS测序技术服务 DRIPc-seq |
|
NGS测序技术服务 环状DNA测序 |
|
基因芯片技术服务 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表观转录组学测序服务 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
NGS测序技术服务 DNA(羟)甲基化测序(抗体法) DNA甲酰基胞嘧啶(5fc)修饰测序 DNA 5hmC 测序(化学法) 染色质免疫共沉淀测序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
|
Ribo-seq Ribo seq |
核糖体-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
宁波大学医学院龚朝辉教授团队主要从事肿瘤分子生物学研究。今年,该研究团队应用Arraystar lncRNA芯片筛选发现了一个在肺癌中异常上调的lncRNA——JPX,该lncRNA分子通过与miR-33a-5p结合而充当Twist1的ceRNA,影响肿瘤的大小、TNM分期和肺癌的转移。进一步深入研究表明,JPX是通过调节miR-33a-5p/Twist1,参与了Wnt/β-catenin信号的激活,进而促进了EMT过程,最终影响了肺癌的发生发展。该研究提示JPX/miR-33a-5p/Twist1轴可能具有治疗肺癌的潜力,具有作为药物作用靶点的潜力。该研究成果发表在Molecular Cancer上(IF:15.302)上。(芯片实验由康成生物丨数谱生物提供技术服务)

|
|
肺癌是最恶性的癌症之一,其5年生存率根据阶段和地区差异在4%至17%之间变化。尽管近年来在肺癌的诊断和治疗方面已经取得了许多进展,但是晚期肺癌的转移仍然是导致高死亡率的主要原因。因此,需要阐明新的致癌途径,精确靶向治疗肺癌。
长非编码RNA(lncRNA)是一类长于200个核苷酸的RNA分子,对癌症的发生、发展有重要影响。异常表达的lncRNA与各种类型的癌症的发生和发展有关,在lncRNA-miRNA-mRNA调控网络中,lncRNA充当特定mRNA的竞争性内源RNA(ceRNA),调节靶基因,影响基因表达。然而,肺癌中异常表达的lncRNA的功能和机制尚不清楚。
Twist1是一种重要的转录因子,可介导上皮-间质转化(EMT)进展和肿瘤转移。此外,Wnt/β-catenin信号传导是EMT和癌症转移的关键驱动因素。作者以前的研究表明,miR-33a-5p负调控Twist1,从而抑制了非小细胞肺癌(NSCLC)的侵袭和转移,miR-33a-5p可以作为早期肺癌诊断的潜在生物标志物。
因此,作者考虑lncRNA是否可以与miR-33a-5p和Twist1形成ceRNA网络以参与肺癌的EMTs和恶性发展过程。
技术路线

研究思路
LncRNA高通量筛选及PCR验证
为了筛选到影响肺癌患者疾病进程的lncRNA分子,作者选择了4对人类肺癌组织和癌旁组织样本,应用Arraystar Human LncRNA芯片筛选差异表达的lncRNA,共筛选出1551个差异表达的lncRNA,其中817个lncRNA表达上调,734个lncRNA表达下调(图1A)。
接下来,使用miRNA-lncRNA相互作用数据库Starbase预测可能与miR-33a-5p相互作用的lncRNA。结果显示61个lncRNA存在miR-33a-5p结合位点。这61个lncRNA与1551个差异表达的lncRNA取交集后发现,lncRNA JPX既在肿瘤样本中表达量出现异常升高,又通过互补碱基对的七个连续配对与miR-33a-5p相互作用(图1B)。
RT-qPCR检测116对肺癌组织和癌旁组织中的JPX表达量,结果显示肺癌组织中的JPX表达明显高于癌旁组织(图1C)。回归分析表明,116例肺癌患者中,JPX的表达与肿瘤大小和TNM分期密切相关(图1D)。
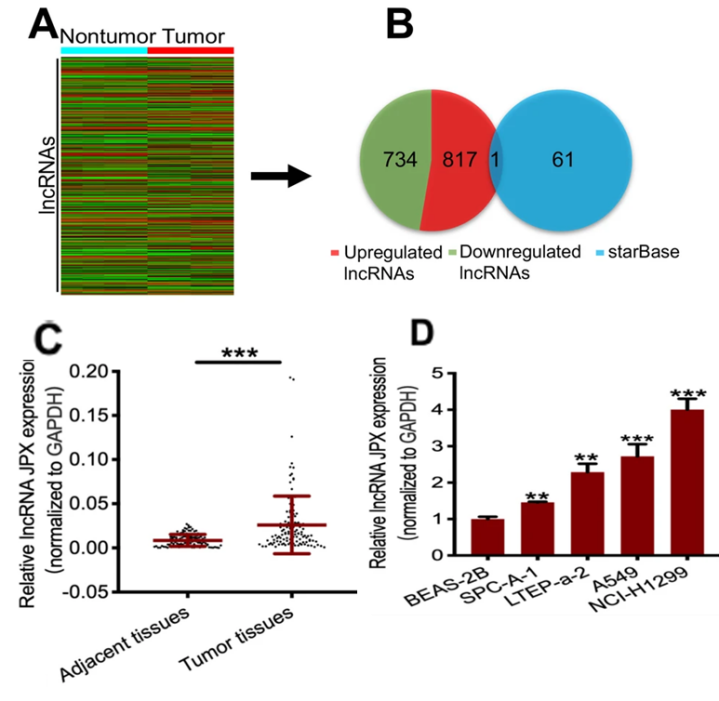
图1. Arraystar Human lncRNA芯片筛选结果及验证
A. 四对肺癌组织和癌旁组织的差异表达的lncRNA。
B. 红色表示肺癌中表达量上调的lncRNA,绿色表示表达量下调的lncRNA。蓝色表示StarBase数据库预测可能和miR-33a-5p有结合的lncRNA数据集。结果的重叠处为lncRNA JPX。
C. RT-qPCR检测到116个配对的肺癌相对于癌旁组织JPX相对表达量上调。
D. RT-qPCR分析四种肺癌细胞系(SPC-A-1,LTEP-a-2,A549,NCI-H1299)相对正常肺上皮细胞系(BEAS-2B)中JPX相对表达量上调
为了研究JPX的生物学功能,使用重组质粒提高JPX在肺癌细胞系中表达,使用siRNA特异性敲低JPX在肺癌细胞系中表达。结果表明,JPX体外过表达促进了肺癌细胞的生长和增殖(图2A,2B,2C),而JPX敲低则抑制了肺癌细胞的生长和增殖。另一方面,利用伤口愈合实验和Transwell分析实验,检测JPX对肺癌细胞迁移和侵袭的影响。结果表明,JPX小鼠体内过表达可以增强肺癌细胞的迁移和侵袭(图2D),而JPX敲低则抑制了肺癌细胞的迁移和侵袭。
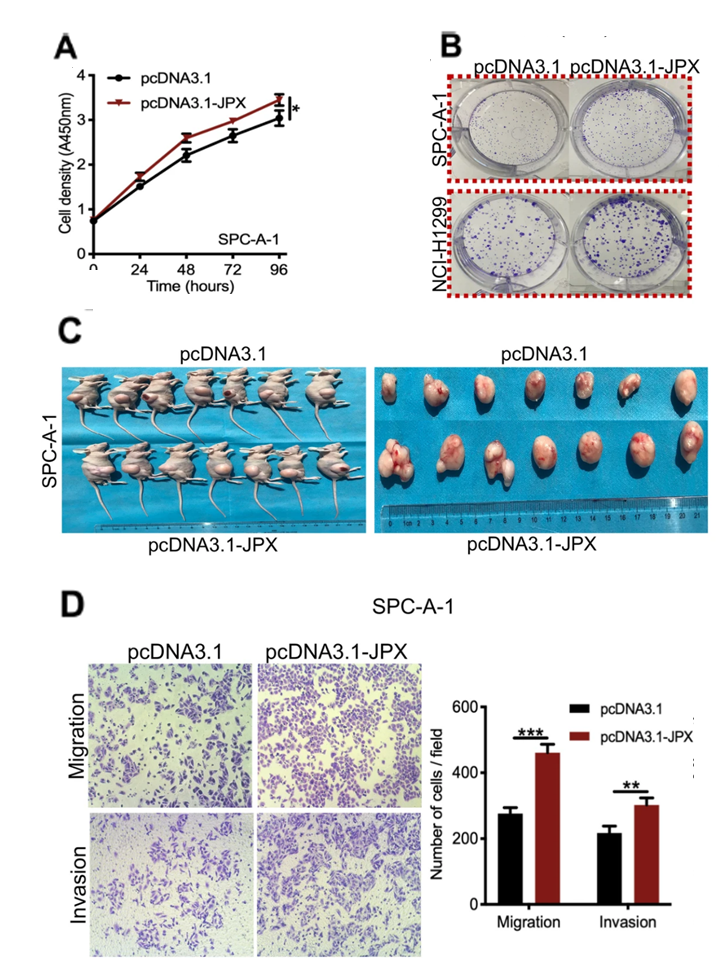
图2. JPX体外过表达促进肺癌细胞的生长和增殖,增强肺癌细胞的迁移和侵袭能力
A. 进行CCK-8检测,分析JPX过表达后肺癌细胞的生存力增强。
B. 集落形成分析法检测JPX过表达后肺癌细胞的增殖能力增强。
C. 裸鼠种植稳定表达JPX的NCI-H1299细胞后,肿瘤生长能力增强。
D. 通过Transwell法检测到JPX过表达后细胞的侵袭能力增强。
机制研究
为了揭示JPX和miR-33a-5p协同调控肺癌进程的生物学机制,首先利用核质分离实验(Nuclear-cytoplasmic fractionation)得到JPX主要定位在肝癌细胞的细胞质中,进一步利用双荧光素酶报告基因实验(dual-luciferase reporters assay)、RT-qPCR、Pearson相关分析,表明JPX发挥ceRNA调控机制,在肺癌细胞中发挥mir-33a-5p海绵的功能,通过靶向结合miR-33a-5p间接调控靶基因(图3A,3B)。体外细胞水平回补JPX的实验结果表明JPX通过调控miR-33a-5p,促进肺癌细胞增殖,迁移和侵袭的能力(图3C,3D)。
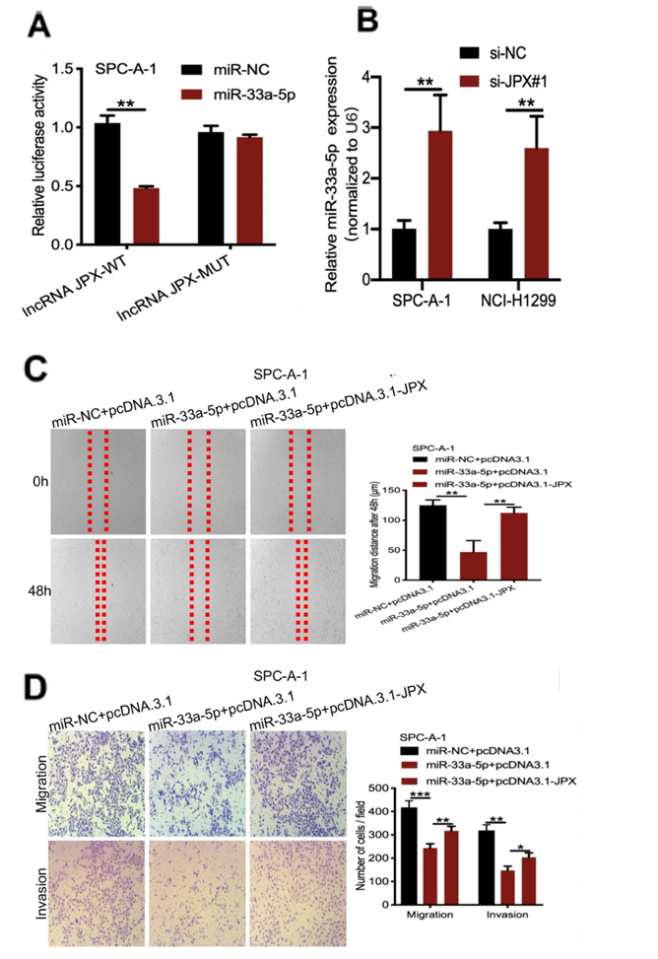
图3. JPX发挥ceRNA调控机制,在肺癌细胞中作为海绵,靶向结合miR-33a-5p
A. 在miR-33a-5p共转染的细胞中,突变的(MUT)JPX报告质粒的相对荧光素酶活性明显高于野生型(WT)质粒。
B. RT-qPCR检测到敲除JPX后miR-33a-5p相对表达量上调。
C. 通过伤口愈合实验检测JPX过表达对miR-33a-5p介导的细胞迁移抑制的回补效应。
D. 通过Transwell检测到JPX过表达对miR-33a-5p介导的细胞侵袭抑制的回补效应。
由于已知研究表明miR-33a-5p负调控其靶基因Twist1,作者进一步研究JPX和Twist1在肺癌中的关系。对95对肺癌组织和癌旁组织样本检测的结果表明,Twist1在肺癌组织中高表达。Pearson相关分析表明,在肺癌患者中,JPX表达与Twist1正相关(图4A)。在肿瘤模型小鼠中,RT-qPCR显示,JPX表达在肿瘤组织中显著上调。JPX过表达诱导肿瘤组织中,Twist1在RNA和蛋白质层面(图4B)表达均增加。总体而言,数据表明JPX和Twist1在肺癌进程中协同上调。
另一方面,已知Wnt/β-catenin信号通路是EMT的驱动器,通过蛋白免疫印迹研究表明,JPX通过调节miR-33a-5p/Twist1,激活Wnt/β-catenin信号传导,介导的EMT进程(图4C,4D)。
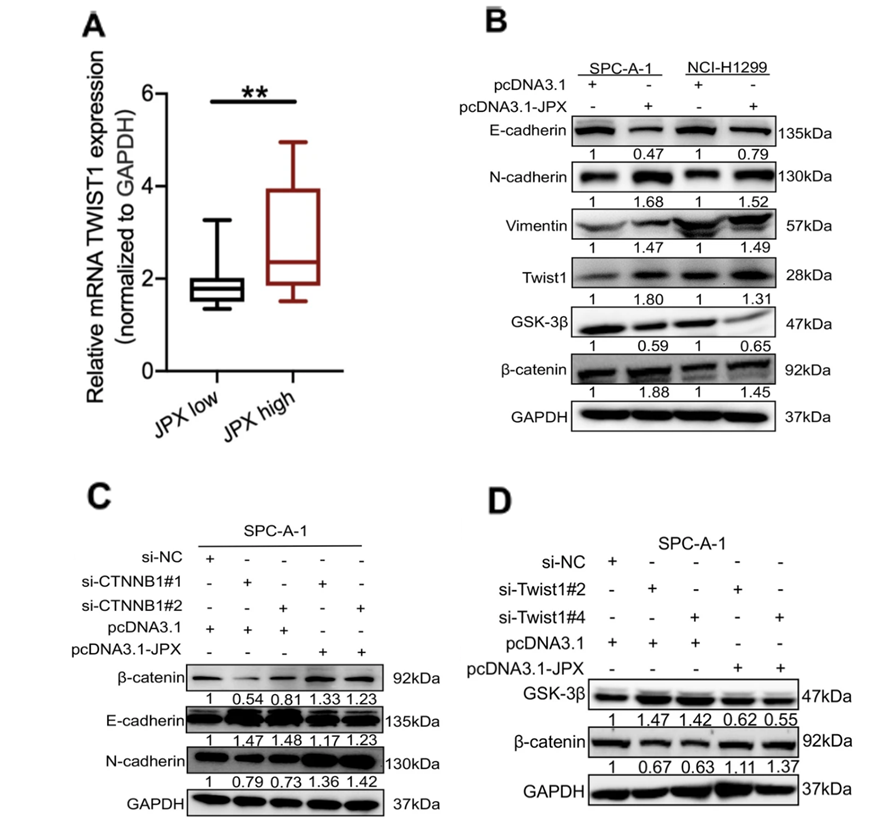
图4. JPX/miR-33a-5p/Twist1通过激活Wnt/β-catenin途径促进肺癌细胞的EMT进展
A. RT-qPCR检测Twist1在JPX表达量高的临床样本中的相对表达量上调。
B. 蛋白免疫印迹检测到过表达JPX的SPC-A-1和NCI-H1299细胞系中,Ecadherin,N-cadherin,Vimentin,Twist1,GSK-3β和β-catenin的表达量。
C. 蛋白免疫印迹检测si-CTNNB1+pcDNA3.1-JPX转染后SPC-A-1细胞中β-catenin,E-cadherin和N-cadherin的表达量。
D. 蛋白免疫印迹检测si-Twist1+pcDNA3.1-JPX转染后的SPC-A-1细胞中GSK-3β和β-catenin的表达量。
总结全文,研究结果表明,JPX/miRNA-33a-5p/Twist1轴可作为新的ceRNA调控网络,通过激活Wnt/β-catenin信号通路参与EMT过程,从而加速了肺癌的恶性进程。这些研究结果提示,JPX可以作为潜在的治疗靶标和精准诊断和治疗肺癌的新型生物标志物。
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-020-1133-9
相关技术服务

