

天然反义转录物(natural antisense transcripts, NATs)是在自然情况下生物体内产生的内源性RNA,它们与对应的互补RNA通过碱基配对,形成自然正义—反义转录物配对的双链RNA,对器官形成、细胞分化和疾病发生等各种生理和病理过程都有重要的调控作用。研究发现,NATs不是某一特定种类,而是具有一些共同特征、分属不同种类的RNA。
NATs在哺乳动物基因组内广泛存在,并且大部分转录单位(TUs)都包含NATs。与此同时,研究还发现NATs具有多个活性启动子,这就证明了NATs在哺乳动物基因组内广泛存在的原因。如FANTOM3数据库报道,小鼠转录组中70%的转录单位含有NATs,并且这些转录物绝大部分是非蛋白编码RNA。
目前研究证明,不论是正义还是反义RNA均可编码蛋白或形成非蛋白编码RNA;但在哺乳动物体内,NATs主要以反义非蛋白编码RNA(Antisense LncRNA)形式存在。Antisense LncRNA的存在给我们以提示: Antisense LncRNA可能会调节蛋白编码的正义RNA。Antisense LncRNA通常在转录水平和转录后水平对基因进行调控。
本文就Antisense LncRNA的调控作用作如下综述。
反义RNA的特点
Antisense LncRNA在基因组中分布极不均匀。Antisense LncRNA常常位于蛋白编码基因两端,如Antisense LncRNA在转录起始位点上游250个核苷酸和基因有义链下游富集。由于Antisense LncRNA很少经历剪接事件,从而导致与正义转录物相比富集程度低。在不同组织和细胞系中,正义和反义转录本的表达水平可以呈正相关也可以呈负相关。此外,研究还发现,人细胞系Antisense LncRNA的表达水平往往与正义基因的表达有关;同时,将内源的Antisense LncRNA进行基因敲除后会出现相应正义转录物出现或升或降的变化;这就表明Antisense LncRNA会在转录水平对正义转录物进行调节。
Antisense LncRNA的特性预示它们在调控基因表达时存在一系列的调控机制。关于反义转录RNA调控正义mRNA有许多假设机制。在此,我们将其归为四类进行讨论:转录水平的调节、RNA-DNA相互作用、RNA-RNA核内相互作用以及RNA-RNA胞质相互作用。
转录水平的调节
Antisense LncRNA行使这种调控机制,是因为其转录方向与正义RNA转录方向相反,而不是Antisense LncRNA本身的调节功能引起的。Antisense LncRNA在转录过程中可能会引起正义RNA的改变;下面就转录碰撞和基因重组两种模型予以分析(图1)。
转录碰撞
在同时转录正义RNA和Antisense LncRNA的过程中,两个RNA聚合酶分别于正-反义基因的启动子区域结合,开始合成RNA,并向各自的3’段移动,这样两个RNA聚合酶在两者之间的重叠区域相遇时,即开始转录碰撞,从而抑制它们的转录过程(图1a)。运用原子力显微技术,这种假设的模型已在Escherichia coli,Saccharomyces cerevisiae中得到证实。在人和小鼠的基因组转录时,转录碰撞可能是Antisense LncRNA调控正义转录物的普遍机制;但是总的来说,有确凿数据支持的转录碰撞的实例非常少。而且,Antisense LncRNA 与其正义基因的转录可能在时间上( 不同生长或发育阶段) 或空间上( 不同染色体) 根本就不可能相遇。这种模型证明了反义RNA是由于与正义RNA转录方向不同而影响正义RNA的合成。但如上所述,正义和反义RNA经常在不同时间、不同染色体上进行转录,所以这种调控模型并不是Antisense LncRNA调控基因表达的主要形式。
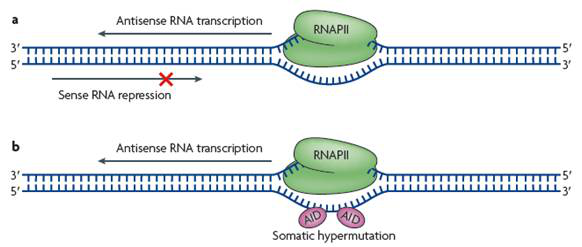
图1.转录水平调节模式图
基因重组
为了适应和应答外界环境的各种刺激,B和T淋巴细胞成熟过程中,在免疫球蛋白和T细胞受体基因的可变区经常发生体细胞超突变(SHM ) 或类型转换重组(CSR) ,以提高抗体对抗原的亲和力,从而产生不同的生理效应;这个过程是转录依赖性的。免疫球蛋白可变区基因的反义转录能够使局部的模板DNA 解链变为单链DNA,释放出空间便于激活诱导胞嘧啶核苷脱氨酶(AID) 靠近单链DNA,使胞嘧啶脱氨变为脱氧尿嘧啶( dU )(图1b)。这一步碱基修饰对体细胞超突变是非常重要的。而目前研究表明在可变区的反义转录使得AID可以靠近单链DNA 。在此模型中,反义转录打开DNA双链形成单链形式,起始AID酶进行的调控,在此过程中会改变染色质结构从而使DNA序列易于重组。在这两中模型中,起作用的是反义转录过程本身,而不是由其产生的Antisense LncRNA的调控作用。
RNA-DNA的相互作用
Antisense LncRNA也可能会通过表观遗传调控发挥功能,这种调控基于直接或间接的RNA-DNA或RNA-染色质相互作用。Antisense LncRNA可能会结合到相应的DNA链上产生DNA甲基化(图2a)或者通过招募组蛋白修饰酶(HME)改变染色质的状态(图2b)。与Dicer酶作用机制不同,Antisense LncRNA会在局部聚集,从而对DNA或染色质进行修饰;这些修饰继而影响到上述修饰区域的相邻区域,这种第二次修饰可能仅仅限于一个基因的启动子或增强子,但不断地发展下去最终会影响到整条染色体,如女性中X染色体的失活。

图2.天然Antisense LncRNA引起染色质和DNA表观遗传的变化
修饰DNA或染色质
Antisense LncRNA可能会引起DNA甲基化、DNA去甲基化和常染色体基因座非印记修饰等。编码正义RNA的DNA启动子区域发生DNA或染色质修饰往往会抑制转录;例如一种Antisense LncRNA会引起α-血清球蛋白基因(HBA2)甲基化,从而导致HBA2基因沉默。
Antisense LncRNA也会通过DNA甲基化或形成异染色质,从而影响到编码p15,p21和孕酮受体(PR)的基因产生转录水平的沉默。有义链启动子区域组蛋白H3的第27个氨基酸上三甲基化(H3K27me3)往往抑制正义转录。如CDKN1A(一种抑癌基因)的Antisense LncRNA通过招募调节复合物诱导H3K27me3,从而抑制有义启动子活性。由于一个细胞特定基因只有两个DNA拷贝,因此,每个细胞内两个Antisense LncRNA足以结合到相应DNA链行使调控功能。
启动子活性与染色质重塑
重叠转录区小RNA(<50nt)、启动子相关小RNA(PASRs)、终止子相关小RNA(TASRs)、启动子上游转录物(PRPMPTs)以及转录起始位点相关RNA(TSSa-RNAs)已在人类基因组中报道。相对于蛋白编码基因往3’端转录,TSSa-RNAs会在活性启动子两侧均有转录。这种异常启动子活性已有充分文献证实,并且在50%以上小鼠和人类基因组均有发现。启动子的这种活性是对传统基因认识的一种挑战,异常的启动子活性暗示了基因不再有明确的5’和 3’端界限的存在。
PROMPTs和TSSa-RNAs的转录区域与RNA聚合酶Ⅱ以及活性染色质重叠,研究表明这种局部RNA的聚集会维持染色质状态,从而有利于启动子的活性。转录起始和终止位点短链RNA以及上游基因的转录往往与活性染色质共定位,预示着这些RNA转录物不仅会调控正义转录物,还会参与染色体的重塑。
基因组印记
在大多数情况下,亲本源的基因均等表达;但在印记基因中,仅特异地表达父源或母源的等位基因。研究发现,Antisense LncRNA往往与基因印记有关,两者之间的相关度在81%以上。如父源表达的胰岛素样生长因子受体2反义RNA(Airn) 通过重叠Igf2r 启动子区域抑制RNA 聚合酶Ⅱ的募集,最终抑制胰岛素样生长因子2型受体(Igf2r)的表达。目前已在人类和小鼠中发现160余种印记基因。
X染色体失活
X 染色体失活过程是指雌性哺乳动物中的两条X 染色体中的一条随机失活,以达到雄性和雌性中表达等量的X 关联基因。来自X 染色体失活中心的两个长链非蛋白编码基因,即X 染色体特异性失活转录物(Xist) 和Xist 的Antisense LncRNA(Tsix) 共同控制着X 染色体的失活。Xist 的表达只来源于失活的X 染色体,通过结合PRC2 复合物,以催化形成H3K27me3,并使PRC2 复合物作用于X 染色体,改变染色质状态,从而抑制基因的转录。Tsix通过对Xist启动子区域的染色质结构进行修饰,抑制Xist 的活性,与后者共同调控X 染色体失活过程。
RNA-RNA核内相互作用
这种机制基于核内反义和正义RNA会形成二聚体(图3Aa)。RNA二聚体的形成会对正义mRNA的表达产生重要影响。核内RNA二聚体的形成会封闭剪接位点,影响mRNA 前体的剪接过程,产生不同的mRNA 成熟体。
选择性剪接
Antisense LncRNA与正义RNA结合形成二聚体会封闭剪接位点,从而改变不同剪接体之间的平衡(图3Ab)。例如甲状腺激素受体有TRα1 和TRα2 两种可变剪接体,二者在细胞内的表达水平保持一定比例,功能上是拮抗的。TRα2 的反义链表达Antisense LncRNA RevErbAα,对TRα2 5’剪接位点的活性有影响,可导致TRα2 的mRNA 水平下调,改变与TRα1 的比例,调节甲状腺激素受体在不同组织或生理条件下的功能状。此外,Antisense LncRNA还会通过类似途径引起聚腺苷酸化影响基因的转录。
mRNA的运输与Antisense LncRNA核滞留
反义和正义RNA二聚体的形成会影响到mRNA的核运输;此外,核内蛋白质或其他RNAs的相互作用会引起Antisense LncRNA在核内滞留,然而目前尚不明确其中的机制。Antisense LncRNA主要存在与细胞核内行使调节功能,诸如低氧、血清饥饿、过氧化物等细胞压力因子的存在会改变核内Antisense LncRNA的存在模式,从而改变相应正义RNA的水平。
mRNA的编辑
Antisense LncRNA还会影响到mRNA编辑(图3Ac),如黑腹果蝇中的一个基因Rnp4f与其反义转录本Sas10,在它们的重叠区会对Rnp4f的mRNA进行腺苷脱氨基至肌苷的转换。果蝇的Sas-10 是Rnp4f 基因的Antisense LncRNA,二者形成双链RNA,在ADAR 的作用下使4f-rnp 的部分腺嘌呤转换为次黄嘌呤,并且导致4f-rnp mRNA 水平的降低。
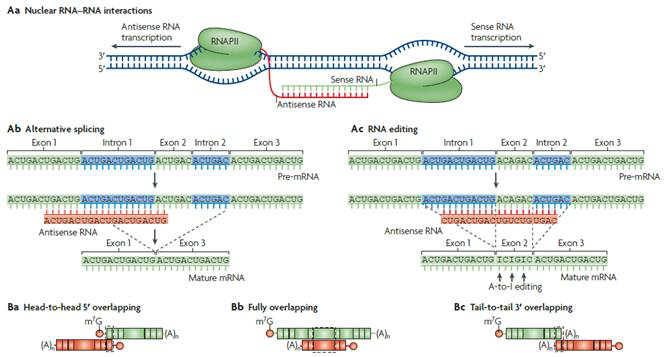
图3.核内和胞质中正义-反义RNA相互配对形成二聚体
RNA-RNA胞质相互作用
这种机制是基于反义RNA和正义RNA在胞质内形成二聚体(如图3Ba-c),形成的发夹结构会影响正义mRNA的稳定性和翻译;或者,该二聚体可能会封闭miRNA结合位点;或这,作为发夹模板产生内源性siRNAs。
影响mRNA的稳定性和翻译
在胞浆中,Antisense LncRNA 通过与正义链mRNA 结合形成双链而影响后者的稳定性和翻译效率。两者的结合区域通过降低mRNA衰退、影响mRNA的稳定性;或者,mRNA此区域通过多种RNases进行一系列内外源核苷酸的剪切而降解。如β位点淀粉样蛋白前体裂解酶1(BACE1) 基因的Antisense LncRNA BACE1-AS 与BACE1 第6 外显子完全重叠,二者形成二聚体可能改变了BACE1的次级或三级结构,从而增强了BACE1 mRNA的稳定性。
当生物体遭受内外毒素、炎症反应等刺激时,诱导型一氧化氮合成酶(INOS) 会被大量合成,以产生足量的一氧化氮发挥多种调节作用。INOS 基因的天然Antisense LncRNA通过与人抗原HuR 相互作用,能够使INOS mRNA 免受核酸酶攻击,从而增强其稳定性,保证一氧化氮合酶的产生能满足细胞代谢的需要。HIF1αAntisense LncRNA αHIF 可以与其3′UTR 的序列结合,改变局部二级结构,使ARE 元件暴露,HIF1αmRNA 在核酸酶的作用下降解。
Antisense LncRNA还会抑制翻译,如B细胞成熟抗原(BCMA)基因的Antisense LncRNA抑制BCMA 翻译,却不会造成BCMA mRNA 水平的变化; 显然它是在翻译水平调控BCMA 的表达。另一个显著的例子是:转录因子PU. 1 的反义RNA 分子可以在翻译的起始和延伸之间抑制翻译的进行,形成的二聚体会影响与核糖体的结合,从而下调PU. 1 的表达,但对PU. 1 的mRNA 水平没有影响。
封闭miRNA结合位点
Antisense LncRNA与其相应正义RNA形成的二聚体会封闭miRNA 的结合位点来维持正义转录物的稳定性。以BACE1为例,其Antisense LncRNA不仅会增强BACE1 mRNA的稳定性(如前文),还会通过覆盖BACE1 mRNA 的miRNA 结合位点以阻止miRNA介导的翻译抑制。FANTOM3数据库报道,至少34%的天然Antisense LncRNA与正义mRNA 3’UTR区域可能形成二聚体;而mRNA 3’UTR区域往往含有miRNA作用的靶位点,所以天然Antisense LncRNA会与miRNA竞争结合3’UTR同一区域,以维持mRNA的稳定性。
内源siRNA的形成
Antisense LncRNA与其正义RNA形成的双链RNA,很可能会在Dicer 的加工下产生内源性siRNA,从而调控基因表达。如在拟南芥中发现一些蛋白编码基因及其反义RNA 可生成内源性siRNA,通过选择性的降解P5CDH mRNA,使细胞内的脯氨酸水平升高以增强拟南芥的抗盐碱。而且,拟南芥中64%以上的蛋白编码基因可以与相应的Antisense LncRNA结合会生成内源siRNA。
类似的发现还有,在X 染色体失活过程中,Tsix 与Xist 形成双链,并倾向形成siRNA;在小鼠卵母细胞中,也发现Antisense LncRNA形成内源性siRNA。该发现,从另一个方面诠释了Antisense LncRNA在转录后水平的调控作用及其与其它RNA 之间的相互关系。
结语
前文中,我们就Antisense LncRNA调节基因表达的功能机制提出了四种模型,并且每种模型都列举了详尽的例子予以阐述。在这四种模型中,如上文所述,转录碰撞模型是不常见的一种调控机制;核内和胞质RNA-RNA之间的相互作用会产生如RNA编辑、剪接等结果,但也不是Antisense LncRNA的主要调控方式。此外,在RNA与DNA相互作用模型中,Antisense LncRNA引起DNA甲基化缺乏大量文献的报道,这种调节可能仅仅发生在一些特定的发育阶段。相反,反义RNA引起的染色体重组可能是许多低拷贝Antisense LncRNA调控的最主要机制;在这种模型中,反义RNA修饰染色体结构,最终抑制有义基因的表达。尽管目前研究表明天然Antisense LncRNA参与多种基因调控通路,但其具体的分子特性目前尚不明确。
虽然目前对天然Antisense LncRNA产生及作用的机制并不完全清楚,但可以肯定的是:它的调控作用在人类基因组中无处不在。目前已有很多研究证实Antisense LncRNA对生物的生长发育和疾病的产生发展有重要的调控作用。如扰乱这些Antisense LncRNA的产生,则会扰乱正义RNA的正常表达,从而对机体生长发育及疾病等产生影响。深入挖掘这些Antisense LncRNA的调控机制必将为相关疾病的临床治疗带了新的突破口,为人类身体健康带来新的福祉。